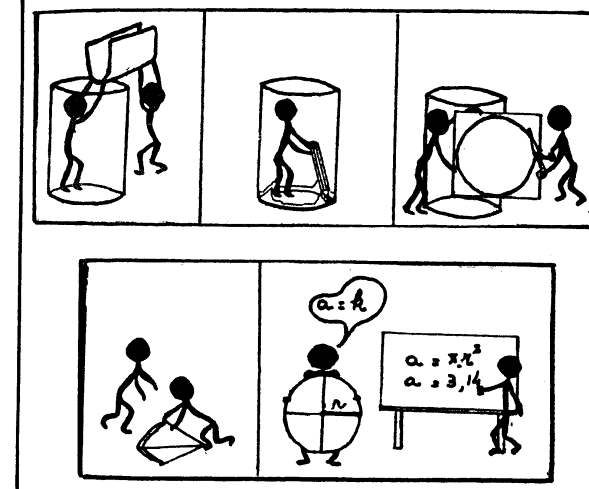|
"... porque el contacto
con lo creado nos acerca al Creador. El hombre, orgulloso de su estirpe, intenta
modelar el mundo a su antojo. Solo cuando comienza a buscar la verdad con
la mente y el corazón, frente a la inmensidad de lo desconocido, descubre
su pequeñez, y entonces se hace grande porque reencuentra su humildad."
M.L.S. |
INTRODUCCIÓN
A
LAS
CIENCIAS NATURALES
EGB 3
Primera Parte
FÍSICO-QUÍMICA
PROF. MARÍA LUZ SILVA
INDICE
CAPITULO UNO
Materia.
Sustancias. Las sustancias y los estados de agregación. Cuerpo. Concepto de
masa y volumen. Introducción al concepto de átomo y molécula. Manifestaciones
de la materia. Fenómenos físicos y químicos.
T.P.N°1:
fenómenos físicos y químicos.
Las
Ciencias. ¿Qué es una ciencia? Introducción al método científico experimental.
Ejercicios.
CAPITULO DOS
¿Qué
es medir? Magnitudes. Unidades.
Sistema
de medidas: Longitud, masa, volumen, capacidad, fuerza. Instrumentos de
medición.
T.P.N°2:
Instrumentos de medición. Unidades fundamentales y unidades derivadas.
Ejercicios.
CAPITULO TRES
Teoría
de error. Valor más probable. Frecuencias. Gráficos de barras. Histogramas.
T.P.N°3:
Mediciones.
Magnitudes
directamente proporcionales. Constante de proporcionalidad.
T.P.N°4:
Magnitudes directamente proporcionales.
CAPITULO CUATRO
Método
científico experimental.
T.P.N°5:
Método científico experimental.
Densidad.
Propiedades intensivas y extensivas.
Ejercicios.
CAPITULO CINCO
Fuerzas.
Concepto. Unidades de fuerza. Magnitudes escalares y vectoriales. La acción de la
gravedad. Peso.
T.P.N°6:
Dinamómetro.
T.P.N°7:
Peso específico.
Peso
específico. Unidades. Diferencia entre masa, peso y volumen.
Ejercicios
y problemas.
CAPITULO SEIS
El
agua. Ciclo del agua. Importancia. Estados de agregación. Características.
T.P.N°8:
Cambios de estado.
Cambios
de estado. Calor y temperatura. Densidad y temperatura.
Ejercicios:
CAPITULO SIETE
Sistemas
materiales. Clasificación. Fases. Sistemas heterogéneos. Métodos de separación.
T.P.N°9:Sistemas
materiales heterogéneos. Sistemas homogéneos. Soluciones: Soluciones saturadas.
T.P.N°10:
Sistemas homogéneos.
Curvas
de solubilidad.
Ejercicios.
CAPITULO OCHO
Presión.
Concepto unidades. Presión hidrostática. Presión ejercida por los gases. El
aire. La presión atmosférica. Variaciones de la presión atmosférica y su
influencia en los puntos fijos.
T.P.N°11:Presión
atmosférica. El aire.
Condiciones
de presión y temperatura de un sistema material. Transformaciones físicas.
Conservación de la masa en las transformaciones físicas.
Ejercicios.
CAPITULO NUEVE
Sustancias
puras. Simples y compuestas. El átomo: Modelo atómico moderno. Tabla periódica
moderna. Peso atómico. Uniones químicas.
T.P.N°12:Concervación
de la masa. Obtención de oxigeno
Conservación
de la masa: formulas y ecuaciones.
|
Dios formó, pues, de la Tierra toda Bestia
del campo, y toda ave de los cielo y las trajo a Adán para que viese cómo las
había de llamar y todo lo que Adán llamó a los animales vivientes, ése es su
nombre" Gen. 1-9 |
CAPITULO UNO
Materia.
Sustancias. Las sustancias y los estados de agregación. Cuerpo. Concepto de
masa y volumen. Introducción al concepto de átomo y molécula. Manifestaciones
de la materia. Fenómenos físicos y químicos.
T.P.N°1:
fenómenos físicos y químicos.
Las
Ciencias. ¿Qué es una ciencia? Introducción al método científico experimental.
Ejercicios.
MATERIA. SUSTANCIA. CUERPO.
Observamos a nuestro alrededor :
los árboles, las nubes, la tierra, un libro, el viento, todo forma parte del
universo. Le damos el nombre de MATERIA. Tomamos una porción de materia,
observamos que ocupa un lugar en el
espacio, es decir, posee VOLUMEN.
Si agitamos la mano, el aire se desplaza: el lugar que ocupa nuestra
mano no es ocupado por el aire.
No toda la materia se presenta en el mismo estado:
Ø El aire es materia
en estado gaseoso.
Ø El agua, el aceite, el alcohol son materia en estado líquido.
Ø Un banco, un trozo de hielo, la arena son materia en estado sólido.
Observamos que no es igual:
Un cubo de hielo a un cubo de madera, aunque ambos están en estado sólido;
El aceite y el alcohol, aunque ambos son líquidos; el gas que se utiliza
en cocinas y estufas y el aire, aunque ambos son gases.
Existen distintas clases de
materia, a cada una de ellas la llamamos SUSTANCIA. Una sustancia puede
presentarse en los tres estados: El agua aparece en la naturaleza en estado
líquido, sólido y como vapor.
Llamamos cuerpo a toda
porción de materia que tiene forma y volumen definido. Así, un banco de madera,
una mesa de madera, son cuerpos distintos, de la misma sustancia. Una bolita de
plomo, una de vidrio, son cuerpos semejantes construidos con distintas
sustancias.
Todo cuerpo esta formado por una cierta cantidad de materia. Si
colocamos un vaso boca abajo, dentro de él, hay aire, una cierta cantidad de
aire.
Fue necesaria una cierta cantidad de vidrio para construir el vaso
.
Llamaremos MASA a la cantidad de materia que conforma
un cuerpo.
Existen otras definiciones de
materia, "materia es todo lo que impresiona nuestros sentidos" en
general, "materia es todo aquello que posee masa y volumen.
Hasta ahora hemos observado y clasificado parte de la naturaleza, pero
la ciencia no es solo clasificación, a los hombres curiosos también les interesa conocer el cómo y el por qué.
A través de los años los hombres de ciencia experimentaron con la naturaleza. Observaron que el quemar azúcar,
por ejemplo, se obtiene otra sustancia. Entonces se preguntaron: ¿derivan las
sustancias unas de otra? O acaso ¿existen infinitas sustancias?
En la antigüedad los creían que las sustancias se trasmutaban unas en
otras. Los alquimistas eran los hombres que experimentaban con la naturaleza,
en busca de la "piedra filosofal", a cuyo contacto todo se convertía
en oro. Si bien no encontraron la tal piedra, sus experiencias fueron las bases
de mucho descubrimientos.
Experiencias de siglos , nos legan nuestro conocimiento de hoy:
Cada sustancia está formada por millones de partículas iguales que la
caracteriza.
Se llama molécula a la menor porción que existe de una
sustancia, sin que ésta pierda sus
propiedades. Si la molécula se rompe, ya no se tiene la misma sustancia.
Cada molécula
contiene otras partículas llamadas átomos
Los átomos pueden ser iguales o distintos
Existen aproximadamente 105 átomos distintos y de la combinación de
ellos resultan todas las sustancias conocidas.
Ø Veamos un ejemplo
En el cajón A hay círculos, en
el B, rectángulos y en el C triángulos
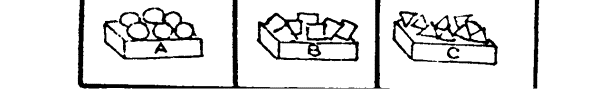
Con ellos podríamos obtener distintos grupos
Y numerosas combinaciones más
Asociemos el concepto
del átomo y molécula al ejemplo: Los grupos representarían la molécula
característica de una sustancia.
Las figuras geométricas, los átomos.
En las SUSTANCIAS COMPUESTAS, la molécula contiene átomos distintos. En
las SUSTANCIAS SIMPLES, ( o sus
variedades alotrópicas) las moléculas contienen átomos iguales
Se llama ELEMENTO a cada tipo de átomo que conforma una sustancia
simple. Los átomos se encuentran clasificados en la Tabla periódica de los elementos.
Así, el agua es una sustancia compuesta cuya molécula contiene dos átomos
de hidrógeno y un átomo de oxígeno. El oxígeno que respiramos es una sustancia simple cuya molécula
contiene dos átomos de oxígeno. El Hidrógeno, el oxígeno son elementos
FENÓMENOS FÍSICOS Y QUÍMICOS
El vuelo de un avión, prender un
mechero, caminar por la habitación, hervir agua, son todas manifestaciones de la materia, es decir, FENÓMENOS.
El agua puede pasar de estado sólido
a líquido, pero la sustancia no cambia. Mezclamos azúcar con leche y ninguna de
las dos sustancias ha sido modificada; en cambio, al quemar azúcar, o una hoja
de papel, sí se verifica un cambio de sustancia.
Llamaremos:
FENÓMENO FÍSICO: todo fenómeno que
al producirse no conduce a un cambio de sustancia.
FENÓMENO QUIMICO, todo fenómeno que
al producirse provoca un cambio de sustancia.
|
Trabajo Práctico 1 OBJETIVO: RECONOCER
FENÓMENOS FÍSICOS Y QUÍMICOS GUIA PARA LA
OBSERVACIÓN Y LA EXPERIMENTACION 1)
Coloque en un tubo de
ensayo un poco de naftalina. Introduzca el tubo en agua hirviendo unos
minutos. Luego enfríe violentamente el tubo 2)
Coloque en un
cristalizador un poco de azúcar. Coloque el cristalizador sobre la llama del
mechero. 3)
Coloque un poco de
leche en tres tubos de ensayo, márquelos 1,2,3. Agregue en 1 un poco de
azúcar, en 2 un poco de bicarbonato de sodio, en 3, un poco de vinagre de
vino. Agite los tres tubos 4)
Coloque en un vaso de
precipitados 50 cm3 de
agua con una cucharada de sal gruesa. Coloque el vaso de precipitados sobre
la llama del mechero, mezcle la sal con el agua, deje consumir el agua ......................... Realice un informe
registrando: acciones, observaciones y conclusiones. |
QUÉ ES UNA CIENCIA
Cada ciencia es un conjunto de conocimientos, ordenado, perfectible
referidos a un OBJETO PROPIO de esa
ciencia. Ésta accede a esos conocimientos aplicando un METODO DE ESTUDIO que
también la caracteriza, y expresa sus conclusiones en un lenguaje específico
Clasificaremos las ciencias en
experimentales y no experimentales
|
|
EXPERIMENTALES |
NO EXPERIMENTALES |
|
OBJETO |
MATERIAL |
NO
MATERIAL |
|
METODO |
CIENTÍFICO
EXPERIMENTAL |
DEDUCTIVO |
|
EJEMPLO |
FISICA,
QUÍMICA, BIOLOGÍA |
MATEMÁTICA,
FILOSOFÍA |
La matemática es una creación de la mente humana. El matemático no
estudia la Naturaleza, sino que "fabrica" sus propios entes y
establece estructuras. Estas estructuras pueden tener modelos materiales, pero
si no los hay no afecta en nada a la ciencia matemática. Una hipótesis en
matemática, es un enunciado que se acepta como verdadero y a partir del cual se
deducen otros enunciados.
En cambio, un físico, un biólogo, un químico, deben observar la
Naturaleza, experimentar con ella y de allí surgen las hipótesis. Hipótesis en
una ciencia experimental es una afirmación hecha sobre la experimentación,
observaciones estadísticas, por la cual se describe, supone y/o pronostica el
comportamiento de un fenómeno. Cuando una hipótesis ha sido comprobada
estadísticamente por la experimentación, entonces se transforma en una ley.
Una ley de la naturaleza no es un mandato, no expresa como las leyes
sociales, una decisión del hombre, un derecho u obligación de un ciudadano. La
ley de la naturaleza no puede ser cambiada como la ley social.
Las leyes en las ciencias experimentales describen el comportamiento de
la naturaleza. Ella tiene sus propias leyes, el hombre las investiga, descubre,
interpreta o pronostica, no las crea. Una asamblea de científicos no podría
decidir, por ejemplo, que a partir de mañana la Tierra girara en otro sentido.
Cuando nos a la ley de Newton
referida a la gravedad, nos referimos a su descubrimiento: Su hipótesis "
la Tierra tiene la propiedad de atraer los cuerpos hacia sí", fue
comprobada a través de los años por un número estadísticamente grande de
experiencias y levó a otros descubrimientos y conclusiones, por ello hablamos
de la LEY de la Gravedad.
Otro científico, llamado Galvani, introdujo dos electrodos en la médula
de una rana y observó que la rana se contraía. Galvani enunció su hipótesis:
"las contracciones se deben a que la rana produce corriente
eléctrica". Esta hipótesis es falsa, como luego demostró Volta, al colocar
los electrodos en un medio acidulado. Volta demostró que, en efecto circulaba
corriente eléctrica, pero no era la rana quien la producía sino las sustancias
que componían la médula.
La hipótesis de Galvani no se transformó en ley porque no fue confirmada
por la experimentación
Para encarar el estudio de una ciencia experimental es necesario observar y experimentar en la
Naturaleza antes de extraer conclusiones. Este es básicamente el Método
Científico Experimental Existen fenómenos para los cuales no es posible
determinar límites precisos entre la Física y la química, sin embargo, en una
primera aproximación podemos decir que la física estudia los fenómenos físicos
y la química aquellos donde hay cambio de sustancias.
En la actualidad, las investigaciones las realizan científicos de
distintas disciplinas trabajando en equipo.
EJERCICIOS.
1) En los hechos en cursiva indique cuáles son fenómenos físicos y
cuales químicos
Un señor le cuenta a otro en la oficina: " Ayer todo fueron
problemas, al abrir la puerta de mi
casa se cortó la luz, así que hube de encender
una vela que se consumió enseguida. Al poco rato volvió la corriente eléctrica: mientras mi esposa preparaba caramelo para un flan, puse agua a hervir y me quemé un dedo. Puse un poco de leche
en mi café, prendí un cigarrillo
y me dispuse a leer el diario, cuando una ráfaga de viento hizo que todas las hojas se desparramaran"
2) Complete el siguiente crucigrama teniendo en cuenta las referencias
horizontales y verticales
|
1 |
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
6 |
|
|
7 |
|
|
8 |
|
|
9 |
|
|
10 |
|
|
11 |
|
|
12 |
|
|
13 |
|
|
14 |
|
15 |
|
|
16 |
|
|
|
|
|
|
|
17 |
|
|
|
|
|
|
|
|
|
|
18 |
|
|
19 |
|
|
20 |
|
21 |
22 |
|
|
23 |
|
|
|
|
24 |
|
|
25 |
|
|
|
|
|
26 |
|
|
|
|
27 |
|
|
|
HORIZONTALES: 1) Terminación utilizada para nombrar las fracciones. 3)
Símbolo químico del cobalto. 4) Virtud teologal. 6) Artículo. 7) Apócope de mamá.
8) Pronombre. 9) Voz del verbo ser, segunda persona, imperativo. 10)
Contracción. 11) Campeón. 12) Nombre de la baraja de valor uno.13)
Artículo. 14) Nombre que se da a cada
tipo distinto de materia. 17) Temor. 18) Preposición.19) Uno de los nombres del
dios sol entre los egipcios. 20) Voz del verbo cortar, primera persona del
presente del subjuntivo. 23) Preposición. 24) Pronombre. 25) Átomo o grupo de
átomo con carga eléctrica. 26) Cantidad de materia que posee un cuerpo. 27)
Fuerza con que la tierra atrae a los cuerpos.
VERTICALES: 1) Parte del cuerpo de las aves. 2)Lugar del espacio que
ocupa un cuerpo.
3) Persona que ha contraído nupcias. 4) Fenómeno natural donde no se
produce cambio de sustancia. 5) Cualquier manifestación de la materia. 7) Todo
lo que conforma el universo. 8) Sonido onomatopéyico que indica golpe. 9) Pronombre. 15) Afirmación. 16) Negación. 18) Verbo dar, tercera persona
del plural, presente del subjuntivo. 20) Tercera letra del abecedario. 21)
Verbo reír, presente del indicativo, primera persona del singular. 22) Expectoración. 24) Artículo.
3) INVESTIGA en alguna publicación o enciclopedia, la narración de algún
hecho científico, e intenta describir después de leerlo, las observaciones y
experiencias efectuadas por el científico y el modo en que arribó a sus
conclusiones.
|
"El hombre vive midiendo y no es medida de
nada, ni de sí mismo." A. Porchia |
CAPITULO DOS
¿Qué
es medir? Magnitudes. Unidades.
Sistema
de medidas: Longitud, masa, volumen, capacidad, fuerza. Instrumentos de
medición.
T.P.N°2:
Instrumentos de medición. Unidades fundamentales y unidades derivadas.
Ejercicios.
Al reconocer algunos fenómenos físicos y químicos hemos observado los
aspectos cualitativos, color, sabor, etc.
Sin embargo, en muchos estudios es necesario considerar los aspectos
cuantitativos, medir cantidades de magnitud.
¿QUÉ ES MEDIR?
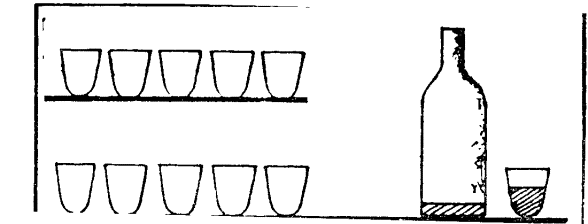
Con un vaso y cantidad suficiente de agua, podemos
llenar una botella. Colocamos cada vez, la misma cantidad de agua en el vaso y
la introducimos en la botella. Supongamos que la botella se llena con diez
vasos de agua. Diremos que la capacidad
de la botella es diez veces la capacidad
del vaso.
Hemos comparado
la capacidad del vaso: Hemos realizado una medición.
Son magnitudes: la superficie, la masa, el volumen, el peso, la
velocidad. Para ellas es posible definir la igualdad, y la suma. Para medir una magnitud se establece una
unidad de ella. La unidad puede ser elegida arbitrariamente.
A través de los siglos,
cada pueblo estableció su propio sistema de medidas. Pero la diversidad de
sistemas producía dificultades en el intercambio cultural y científico.
A mediados del siglo
diecinueve, se unificaron las medidas de magnitudes con el sistema Métrico
Internacional. Una de las ventajas de este sistemas es que los múltiplos y
submúltiplos de las unidades de medidas de magnitud, se obtienen, multiplicando
o dividiendo por múltiplos o submúltiplos de 10
UNIDADES DE MEDIDAS
|
MEDIDAS DE LONGITUD |
||||||
|
km |
hm |
dam |
m |
dm |
cm |
mm |
|
kilómetro |
hectómetro |
decámetro |
metro |
decímetro |
centímetro |
milímetro |
0,001km = 0,01 hm = 0,1 dm =1m =10dm
= 100 cm = 1000 mm
|
MEDIDAS DE SUPERFICIE |
||||||
|
km2 |
hm2 |
dam2 |
m2 |
dm2 |
cm2 |
mm2 |
|
Kilómetro cuadrado |
Hectómetro cuadrado |
decámetro cuadrado |
Metro cuadrado |
Decímetro cuadrado |
Centímetro cuadrado |
milímetro cuadrado |
|
MEDIDAS DE VOLUMEN |
||||||
|
km3 |
hm3 |
dam3 |
m3 |
dm3 |
cm3 |
mm3 |
|
Kilómetro cúbico |
hectómetro cúbico |
decámetro cúbico |
Metro cúbico |
Decímetro cúbico |
Centímetro cúbico |
Milímetro cúbico |
|
MEDIDAS DE CAPACIDAD (VOLUMEN) |
||||||
|
kl |
hl |
dal |
l |
dl |
cl |
ml |
|
kilolitro |
hectolitro |
decalitro |
litro |
decilitro |
centilitro |
mililitro |
|
MEDIDAS DE MASA |
||||||
|
kg. |
hg |
dag |
g |
dg |
cg |
m |
|
kilogramo |
hectogramo |
decagramo |
gramo |
decigramo |
centigramo |
miligramo |
Para las medidas de Peso se utiliza como unidad el gramo fuerza (gf)
EQUIVALENCIAS
Se establece una equivalencia entre las unidades de capacidad y las
unidades de volumen:
1ml = 1 cm3
Si construimos un cubo de 1 cm de
arista, el volumen del cubo será de 1 cm3, y ese cubo contiene 1ml
de agua.
Si el agua de nuestro cubo lo
colocamos en un frasco, la columna de agua tendrá una altura h, diremos que
hasta esa altura, el frasco contiene 1 ml o 1 cm3 de agua
INSTRUMENTOS DE MEDICIÓN
Para
medir longitudes, áreas o volúmenes podemos fijar una longitud, un área o un
volumen elegido arbitrariamente. A así como lo hemos hecho en el ejemplo del
vaso y la botella podríamos medir la superficie del piso tomando como unidad la
medida de la superficie de una baldosa
Cuando obtenemos una medida por
comparación directa con la unidad, la medición se llama directa. Pero, en otros
casos muy frecuentes, las mediciones son indirectas: en el reloj de tiempo de
dos agujas el ángulo que ellas forman indican la hora, el velocímetro de un
automóvil, etc.
|
Trabajo Práctico N° 2 INSTRUMENTOS DE MEDICIÓN OBJETIVO:
Construir instrumentos de medición indirecta a)
Construcción de una probeta b)
Construcción de un dinamómetro c)
Construcción de una balanza de dos platillos GUIA DE TRABAJO A) Construcción de una probeta: Un
tubo de plástico transparente, cilíndrico de base plana, una pipeta ( puede
ser reemplazada por una jeringa), tela adhesiva. -
Pegue la tela adhesiva al tubo en forma longitudinal -
Coloque una cantidad fija en la pipeta -
Eche el agua en el tubo, marque la altura en la tela adhesiva -
Repita el procedimiento hasta llenar el tubo -
Marque el cero de la probeta construida en la base
interior
B) CONSTRUCCIÓN DE UN DINAMÓMETRO Clavo de dos pulgadas, resorte blando , platillo de
una pulgada de radio, , una varilla y una base de cualquier material (
madera, metal). La varilla debe tener por lo menos tres veces el largo del
resorte. Pesas (pueden reemplazarse por monedas. Arme el dispositivo como indican las figuras
Agregue una pesa, marque el estiramiento, siga
agregando pesas iguales una por una, y marcando los respectivos estiramientos
hasta que el resorte se estire aproximadamente al doble de su longitud
inicial.
La
probeta construida nos permitirá medir volúmenes, la altura de la columna de
líquido indicará el volumen El
resorte nos permitirá medir pesos. El alargamiento del resorte lo indicarán,
son mediciones indirectas |
UNIDADES FUNDAMENTALES Y UNIDADES DERIVADAS
Se llaman unidades fundamentales
aquellas que pueden definirse arbitraria e independientemente, una de otras. Y
unidades derivadas aquellas que se relacionan con las unidades fundamentales
mediante una ecuación.
El siguiente cuadro muestra los sistemas de medidas más usados, sus
unidades fundamentales y algunas unidades derivadas.
|
|
MAGNITUD |
SISTEMA cgs |
SISTEMA MKS |
SISTEMA TECNICO |
|
UNIDADES FUNDAMENTALES |
LONGITUD |
cm |
m |
m |
|
MASA |
g |
kg. |
--------- |
|
|
TIEMPO |
seg. |
seg. |
Seg |
|
|
FUERZA |
------ |
----- |
kgf |
|
|
UNIDADES DERIVADAS |
MASA |
------- |
------ |
UTM |
|
FUERZA |
dina |
newton |
------ |
|
|
SUPERFICIE |
cm2 |
m2 |
m2 |
|
|
VOLUMEN |
cm3 |
m3 |
m3 |
|
|
DENSIDAD |
g/ cm3 |
kg/ m3 |
|
|
|
VELOCIDAD |
cm/ seg |
m/ seg |
m/ seg |
PATRONES DE MEDIDA
Para unificar los sistemas de medidas, en 1979, se introdujeron los
patrones de medidas para las magnitudes de masa, longitud y tiempo.
La unidad de longitud se
estableció como la diezmillonésima parte del meridiano terrestre que pasa por
París. Fue construida una barra de platino e iridio, aleación de bajo coeficiente de dilatación térmica, con la
longitud fijada y se la llamó metro
patrón
La unidad de masa, llamada kilogramo masa patrón, se fijó como la
de una pesa de la misma aleación que el metro patrón, cuya masa es igual a la
de un decímetro cúbico de agua destilada y a una temperatura de 4" C
Se definió la unidad de fuerza,
el kilogramo fuerza como el peso de la unidad de masa en el lugar donde se
guarda (Oficina de pesos y Medidas de Francia)
La unidad de tiempo se
estableció como la 1/86.000 ava parte del día solar medio.
Actualmente existen otras definiciones para los patrones:
Segundo: es la duración de 9.192.631.770
períodos de radiación entre dos niveles superfinos del estado fundamental del
átomo de Cesio, número másico 133
El metro patrón, contiene
1.650.753,73 longitudes de en el vacío de la línea espectral que corresponde a
la transición del electrón entre los estados cuánticos 2p10 y 5d5
Para la unidad de fuerza se
adopta el Newton
EJERCICIOS
1)
Calcule cuantos metros mide:
-
una lombriz de 30 mm
-
una un camino de 0,31 km
2)
En un vaso caben 20 ml de agua . El baldecito de mi hermanito tiene una
capacidad de 90 cm3. ¿Con cuántos vasos puedo llenar el balde?
3)
Coloque verdadero o falso según corresponda
|
La química no es una ciencia
experimental |
|
||
|
La masa es la cantidad de materia que tiene un cuerpo |
|
||
|
Medir es comparar |
|
||
|
Cuando al producirse un fenómeno no hay cambio de sustancia entonces
se trata de un fenómeno químico |
|
||
|
El peso puede medirse en metros cúbicos |
|
||
|
Cada tipo distinto de materia se llama sustancia |
|
||
|
El método científico experimental es utilizado por la Matemática |
|
||
|
Los científico dictan leyes y la Naturaleza las obedece |
|
||
|
16 ml es igual a |
0,016 litros |
|
|
|
0,016 cm3 |
|
||
|
0,016 dm3 |
|
||
|
1,04 m2 es igual a |
104 dm2 |
|
|
|
1.040.000 mm2 |
|
||
|
0,104 dam2 |
|
||
4)
¿Cuántos milímetros son un cuarto
de metro
5)
¿Cuántos litros de agua hay en una jeringa que contiene 12 ml de agua?
|
"y si en
adelante te fallan todas las escalas, será
indispensable que sepas treparte sobre tu propia cabeza. ¿Qué otra
cosa podrías hacer para subir más alto? Nietzsche |
CAPITULO
TRES
Teoría de
error. Valor más probable. Frecuencias. Gráficos de barras. Histogramas.
T.P.N°3:
Mediciones.
Magnitudes
directamente proporcionales. Constante de proporcionalidad.
T.P.N°4:
Magnitudes directamente proporcionales.
TEORÍA DE ERROR
Los instrumentos de medición se construyen con referencia a los
patrones. La mayoría de ellos se fabrican en serie lo que no implica
necesariamente que sean absolutamente iguales, ni que todos tengan la misma
precisión. Además, a través del tiempo, por efecto del uso, los instrumentos
sufren dilataciones y/o desgastes. Todos los instrumentos usados para medir
producen una incerteza u error en la medición. Ninguna medida es absolutamente
cierta.
La estimación de los errores o incertezas debidas a los instrumentos se
realiza mediante la aplicación de la llamada teoría de error.
Al realizar una medición pueden
verificarse otros errores debidos al observador, o a las condiciones
ambientales, Estos errores no pueden sistematizarse, no pueden predecirse. No
es aplicable para ellos esta teoría.
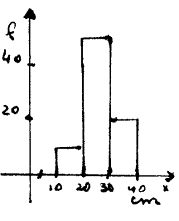
Al medir 21 veces el largo de un lápiz se obtuvieron los datos de la
tabla 1, de la siguiente manera: Se tomó el largo del lápiz con un trozo de
hilo y luego se transportó esa medida sobre una regla graduada
|
i |
xi |
|
1 |
20,1 |
|
2 |
20,2 |
|
3 |
20,1 |
|
4 |
20,2 |
|
5 |
20 |
|
6 |
20,1 |
|
7 |
20,3 |
|
8 |
20,2 |
|
9 |
20,4 |
|
10 |
20,1 |
|
11 |
20,3 |
|
12 |
20,2 |
|
13 |
20,3 |
|
14 |
20,2 |
|
15 |
20,1 |
|
16 |
20,2 |
|
17 |
20,1 |
|
18 |
20,2 |
|
19 |
20,3 |
|
20 |
20,4 |
|
21 |
20,2 |
|
|
424,2 |
A partir de los datos de la tabla , obtenemos el VALOR MAS PROBABLE o
valor más representativo de la medición calculando el promedio de los valores
obtenidos. Es decir se suman todos los valores y se divide por el número de
mediciones.
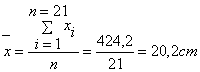
Obtenido el valor más probable es necesario acotarlo es decir, indicar
entre que extremos puede variar. Para ello es necesario realizar otros cálculos
que exceden la profundidad de este curso. Para acotar el valor más probable
tomaremos la menor división de la regla utilizadas decir 1 mm = 0,1 cm y
expresamos el valor más probable así:
![]()
Observamos en la tabla 1 que varios valores de la medición se repiten
Se llama FRECUENCIA de una
medición el número de veces que aparece. Por ejemplo el 20,1 apareció seis
veces. Entonces tiene frecuencia 6.
La tabla dos se confecciona a partir de la tabla 1, y se denomina TABLA
DE FRECUENCIAS
|
xi |
fi |
xi
fi |
|
20 |
1 |
21 |
|
20,1 |
6 |
120,6 |
|
20,2 |
8 |
161,6 |
|
20,3 |
4 |
81,2 |
|
20,4 |
2 |
40,8 |
|
|
21 |
424,2 |
Para obtener el valor más probable de una medición a partir de la tabla
de frecuencias :
Ø Se halla el
producto entre cada valor de medición y su frecuencia
Ø
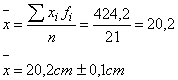
Se suman
los productos obtenidos y el resultado se divide por el número de mediciones
)es decir la suma de todas las frecuencias
REPRESENTACIÓN GRÁFICA DE LOS DATOS
Los datos obtenidos en las mediciones se representan gráficamente, para
facilitar sus uso y el análisis de los resultados.
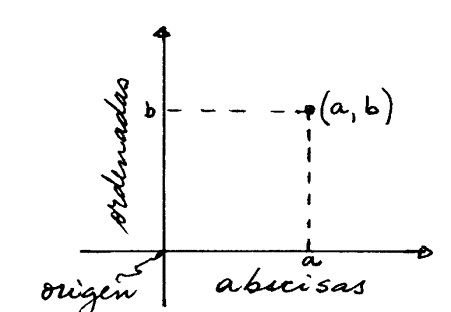
Para representar los datos de una medición utilizamos un sistema de
coordenadas cartesianas, dos rectas perpendiculares entre sí.
La recta horizontal se denomina
eje de abscisas, la vertical eje de ordenadas. El punto de intersección se
llama origen de coordenadas.. Hacia la derecha y hacia arriba se indica el
orden creciente de las rectas.
En cada eje se establece una escala y cada punto del plano queda
determinado por un par ordenado (a;b) donde a es el valor de la abscisa y b el
de la ordenada.
Establecer una escala significa definir una correspondencia entre los
puntos del eje y un conjunto numérico, o como en este caso establecer una
correspondencia entre una longitud y la magnitud que se desea representar. Por
ejemplo, si queremos dibujar el plano de una casa en una hoja de papel, no
podemos tomar las medidas reales, entonces establecemos una escala: a cada cm
del cuaderno, en el largo y ancho, le corresponde un m de la realidad. Con esta
escala es posible hacer el plano.
GRAFICOS DE BARRAS
Para realizar estos gráficos utilizamos las tablas de frecuencias. En el
eje de ordenadas se representan las frecuencias y en el de abscisas las
mediciones.
El gráfico siguiente se confeccionó a partir de la tabla 2
Elegimos una escala para cada eje:
Ø En el eje de
ordenadas a cada cm del eje le corresponde 2 de frecuencia
Ø
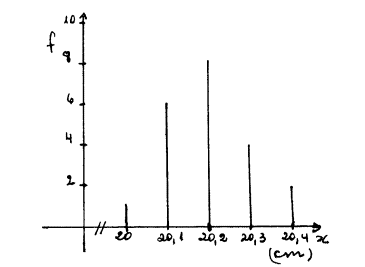
En el eje
de abscisas a cada cm del eje le corresponden 0,1 cm de la medición. Con esta
escala, si graficamos el eje completo debería medir 200 cm, pero cortamos el
eje y representamos sólo el intervalo que nos interesa. Este corte lo
representamos en el gráfico con //
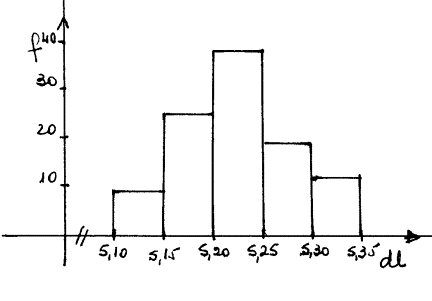
HISTOGRAMA
Se utilizan los histogramas cuando
el número de mediciones es muy grande. Las mediciones se agrupan en intervalos
y la frecuencia
Los valores de la medición se
agrupan en intervalos , y las frecuencias se determinan para cada uno de ellos.
El gráfico entonces, se forma con rectángulos cuya base en el eje de abscisas
es un intervalo de los valores de la medición y cuya altura es la frecuencia del intervalo.
|
i |
Vi |
i |
Vi |
i |
Vi |
i |
Vi |
i |
Vi |
|
1 |
5, 12 |
21 |
5,20 |
41 |
5,13 |
61 |
5,21 |
81 |
5,23 |
|
2 |
5,32 |
22 |
5,16 |
42 |
5,16 |
62 |
5,23 |
82 |
5,26 |
|
3 |
5,33 |
23 |
5,21 |
43 |
5,16 |
63 |
5,24 |
83 |
5,27 |
|
4 |
5,21 |
24 |
5,28 |
44 |
5,23 |
64 |
5,21 |
84 |
5,27 |
|
5 |
5,20 |
25 |
5,26 |
45 |
5,16 |
65 |
5,21 |
85 |
5,24 |
|
6 |
5,18 |
26 |
5,21 |
46 |
5,21 |
66 |
5,28 |
86 |
5,27 |
|
7 |
5,20 |
27 |
5,26 |
47 |
5,16 |
67 |
5,27 |
87 |
5,28 |
|
8 |
5,20 |
28 |
5,28 |
48 |
5,35 |
68 |
5,21 |
88 |
5,27 |
|
9 |
5,33 |
29 |
5,23 |
49 |
5,15 |
69 |
5,23 |
89 |
5,22 |
|
10 |
5,23 |
30 |
5,22 |
50 |
5,18 |
70 |
5,27 |
90 |
5,28 |
|
11 |
5,16 |
31 |
5,21 |
51 |
5,13 |
71 |
5,26 |
91 |
5,26 |
|
12 |
5,22 |
32 |
5,24 |
52 |
5,20 |
72 |
5,35 |
92 |
5,12 |
|
13 |
5,20 |
33 |
5,35 |
53 |
5,18 |
73 |
5,35 |
93 |
5,34 |
|
14 |
5,34 |
34 |
5,23 |
54 |
5,23 |
74 |
5,22 |
94 |
5,35 |
|
15 |
5,18 |
35 |
5,23 |
55 |
5,16 |
75 |
5,21 |
95 |
5,21 |
|
16 |
5,21 |
36 |
5,26 |
56 |
5,21 |
76 |
5,26 |
96 |
5,35 |
|
17 |
5,18 |
37 |
5,27 |
57 |
5,16 |
77 |
5,22 |
97 |
5,31 |
|
18 |
5,20 |
38 |
5,23 |
58 |
5,23 |
78 |
5,22 |
98 |
5,24 |
|
19 |
5,20 |
39 |
5,16 |
59 |
5,26 |
79 |
5,22 |
99 |
5,24 |
|
20 |
5,21 |
40 |
5,19 |
60 |
5,14 |
80 |
5,26 |
100 |
5,25 |
TABLA DE FRECUENCIAS
|
INTERVALO |
f |
Marca del
intervalo |
|
[5,10 - 5,15) |
9 |
5,125 |
|
[5,15 - 5,20) |
25 |
5,175 |
|
[5,20 - 5,25) |
38 |
5,225 |
|
[5,25 - 5,30) |
19 |
5,275 |
|
[5,30 - 5,35] |
12 |
5,325 |
Se aclara que.
El intervalo [5,10 - 5,15) contiene
los valores que son mayores o iguales a 5,10 y menores a 5,15. Los que son iguales a éste están en el
intervalo siguiente.
Para calcular el valor más probable
de una medición usando una tabla de frecuencias por intervalos, se debe
determinar el punto medio, marca del intervalo y utilizarlo para multiplicarlo
por la frecuencia
HISTOGRAMA
Si el número de mediciones es muy
grande las barras del gráfico tienden a estar más juntas. Un número infinito de
mediciones tendría por gráfico un área
limitada por la curva. Diremos que una medición es estadísticamente correcta,
si la poligonal que determinan los puntos del gráfico tiende a la curva de
Gauss.
ERROR APARENTE
Se denomina error aparente de una
medición a la diferencia entre la medición y el valor más probable
![]()
Si el error aparente es negativo
diremos que la medición tiene un error por defecto. Si es positivo la medición
tiene un error por exceso
ERROR RELATIVO
El error relativo es el cociente
entre el error aparente y el valor más probable de la medición. . Se utiliza
para comparar mediciones ya que no tiene unidades
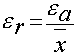
|
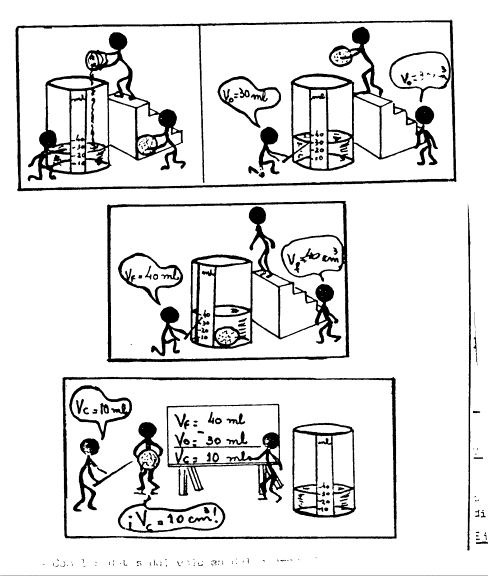
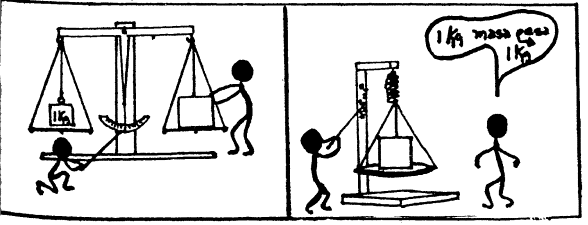
TRABAJO PRACTICO 3 MEDICIONES OBJETIVO:
Aplicar la teoría de error a)
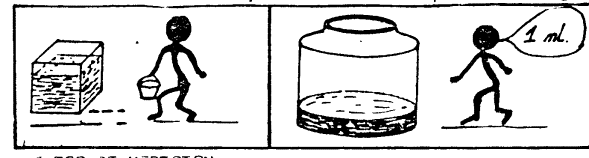
Medición de un volumen Use
una piedra u otro objeto irregular y la probeta construida en el trabajo
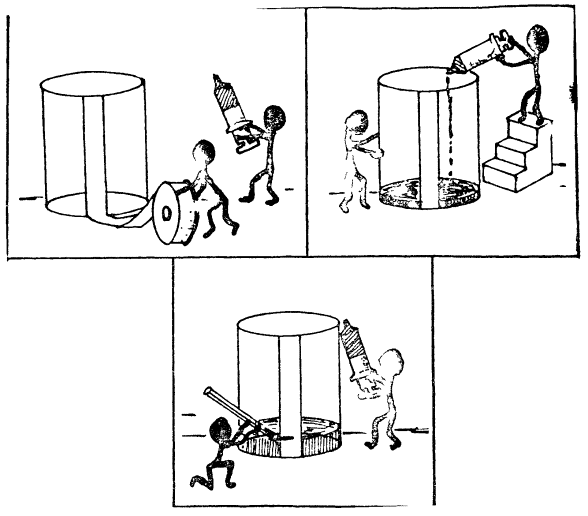
práctico anterior. Todo el grupo medirá el volumen del mismo objeto en su
propia probeta. El procedimiento se indica en la historieta
b)
Medición de una longitud Con un trozo de hilo mida la circunferencia
de la base de su probeta, luego transporte la medida sobre una regla. Repita
el procedimiento dos o tres veces. Si
trabaja en grupo comparta resultados. Calcule
en cada caso. El volumen más probable y la medida probable de la
circunferencia. Aplique
los conceptos de error aparente y de error relativo |
MAGNITUDES PROPORCIONALES
Hasta ahora hemos considerado
situaciones donde interviene sólo una
magnitud. Pero, en la mayoría de los fenómenos que estudia la ciencia
intervienen más de una magnitud
EJEMPLO 1
La tabla indica los espacios
recorridos por un móvil en diversos intervalos de tiempo consecutivos. En el
gráficos están representados los datos de la tabla: En el eje de ordenadas, el
espacios recorrido y en el eje de abscisas el tiempo.
Hemos representado el espacio en
función del tiempo. Esto significa que los espacios dependen del tiempo
transcurrido
El tiempo es la variable
independiente, se grafica en el eje x
El espacio, la variable dependiente
se grafica en el eje de ordenadas.
En la tabla puede verificarse que el
cociente entre cada espacio recorrido y el tiempo empleado en recorrerlo se
mantiene constante
|
t (seg) |
e (cm) |
|
1 |
3 |
|
3 |
9 |
|
4 |
12 |
|
5 |
15 |
|
8 |
24 |
|
9 |
27 |
|
10 |
30 |
La constante, que llamaremos k, se puede calcular
tomando cualquier punto de la re recta y dividiendo la ordenada por la abscisa.
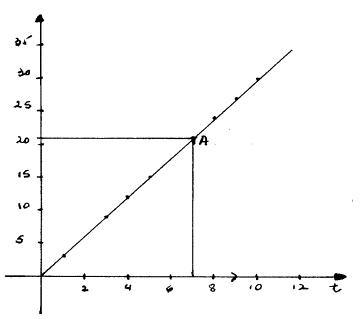
Para el
punto A:
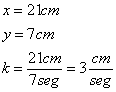
La constante es la velocidad del
móvil.
Dos magnitudes A y B son directamente proporcionales si el cociente entre
A y B se mantiene constante.
![]()
|
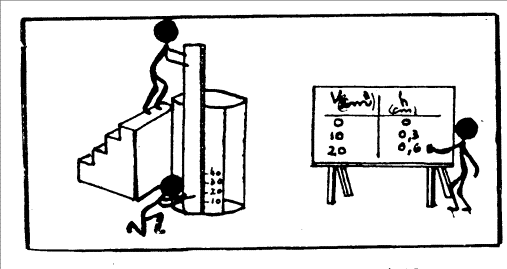
TRABAJO PRACTICO NÚMERO 4 MAGNITUDES DIRECTAMENTE PROPORCIONALES OBJETIVO:
Determinar la constante de proporcionalidad relacionando dos magnitudes PRIMERA PARTE. Utilizando
la probeta construida en el TP 2 y una regla graduada en milímetros,
procedemos así: Ø
Se miden las alturas correspondientes a cada volumen
tabulado
Ø
Con los valores obtenidos se construye una tabla
relacionando cada volumen (V) con la altura (h) de la columna Ø
Se grafican los datos La el volumen en función de la altura. Ø
Se determina la constante que quedará expresada en
cm2 , es decir que la constante es una superficie. Ø
Imagine que Ud. congela agua tomando distintos
niveles de agua de su probeta. Los trozos de hielo resultantes serán
cilindros de disto volumen y distinta altura pero tendrán la misma base. El
valor de la constante da la superficie de la base interior de la probeta SEGUNDA
PARTE Determinamos
la superficie de la base interior de la probeta para comparar con la
constante hallada.
Calcule
el área de la base usando la fórmula matemática para calcular el área del
círculo. Compare
con la constante de la primera parte de este práctico
|
EJERCICIO
Le tomaron una evaluación a Juancito
donde cada respuesta correcta vale un punto.
Aquí está la evaluación. Obtuvo 6
puntos. Indique donde están los errores y complete las respuestas que no dio
Coloque Verdadero o Falso en las
siguientes afirmaciones
|
Al realizar
una medición siempre se obtiene el valor exacto |
F |
|
El valor más
probable de una medición se obtiene sumando todos los valores y dividiendo
por el número de mediciones |
V |
|
La teoría de
Error permite acotar las incertezas de la medición |
V |
|
Se llama
frecuencia de una medición al número de veces que aparece esa medición |
F |
|
Si al
graficar dos magnitudes, el gráfico da una recta, entonces las magnitudes son
directamente proporcionales |
V |
|
El error
relativo permite comparar mediciones
de distintas magnitudes |
V |
Según el histograma de la figura,
Se realizaron..........mediciones.
El valor más probable es........
La medición 10,5 tiene un error
por...................
La medición.............tiene un
error por exceso
000000000000000000000000000000000000000000000000000000000000000000000000
|
" El simple
todo lo cree, más el avisado mira bien sus pasos". "El corazón del
entendido busca la sabiduría. Más la boca de los necios se alimenta de
necedades" Prov. 14-15;15-14 |
CAPITULO
CUATRO
Método
científico experimental.
T.P.N°5:
Método científico experimental.
Densidad.
Propiedades intensivas y extensivas.
Ejercicios.
El método científico experimental es
el modo de conocer en las ciencias
experimentales, nos señala cómo se aborda la investigación y el modo de arribar
a las conclusiones.
Podemos entonces establecer sus
etapas:
-
El científico se plantea un problema: Algo en la Naturaleza despierta su
curiosidad y se pregunta ¿por qué?
-
Entonces comienza el proceso de observación
-
Ello no
significa sólo "mirar", sino registrar cuidadosamente todas las
variables, cualitativas y cuantitativas que intervienen.
-
Esto permite enunciar las hipótesis, con éstas se clasifica el fenómeno,
o se infieren las causas que los producen, o se establecen relaciones entre las
magnitudes que intervienen y lo definen
-
Sobre la base de las hipótesis
el científico continúa sus
experiencia, controlando y analizando los factores que intervienen o modifican
para verificar su hipótesis
-
Las leyes en las ciencias experimentales, adquieren ese carácter cuando
las hipótesis se comprueban mediante la experimentación
-
El método científico exige hacer uso de todas las pruebas y
conocimientos que se refieran a lo que se está analizando, asimismo requiere
validez de técnicas y análisis riguroso de los datos obtenidos.
-
Es por ello que el científico
debe poseer honestidad intelectual. Las ideas preconcebidas o los prejuicios no
deben influir en sus conclusiones, sino que éstas están basadas en la certeza
de los hechos. Tampoco los juicios, conclusiones o conclusiones no deben ser
precipitados: no los formulará antes de conocer la validez de las pruebas, la
totalidad de los hechos disponibles. La búsqueda de la verdad es la finalidad
de la Ciencia
.Numere los cuerpos. L os valores obtenidos
debe registrarlos
cuidadosamente
|
cuerpo |
masa
(3) |
volumen (cm3) |
|
|
|
|
- Grafique los datos de la tabla: masa en función del volumen y determine le
recta aproximada.
(Si los puntos no está perfectamente alineados, la recta se traza tratando de
que toque la mayor cantidad de puntos posible)
- Determine la constante del gráfico-
NOT A: Si los
puntos no resultan alineados es posible que la
incertaza de las mediciones sean grandes o bien que
al material que Ud. utilizó contenga demasiadas
impurezas. Si Ud. no ha podido verificar que, masa y volumen en cuerpos de la
misma sustancia son proporcionales: no precipite
sus conclusiones; trate de eliminar las incertezas;
repita la experiencia,
EXPERIENCIA 4;
- Determine la masa de la probeta construida en el TP,N° 2 (mp)
- Coloque agua hasta la primera marca de volumen. Determine la
masa (m), (La masa
correspondiente a ese volumen de
agua será m - mp) ,
- Agregue agua hasta la
segunda marca. Determine la masa.
- Continúe con el proceso
hasta llenar le probeta.
Construya una tabla:
|
m |
V |
|
(g) |
(ml) |
|
|
|
(Recuerde que la masa de cada
volumen de agua se obtiene después de restarle la masa de la probeta).
- Grafique la masa en función del volumen.
-
Calcule la
constante de
proporcionalidad.
Si la balanza de dos platillos no tiene gran precisión, o no se posee, los cuerpos puedan pasarse primero. Se ha dicha que 1 kg. masa pesa 1 kgf en al lugar donde se guardan los patrones, por lo tanto se
puede admitir que
si un cuerpo posee una mesa de 10 g, entonces pesa 10 gf.
Para evitar errores de paralaje, al medir volúmenes debe colocar la
probeta a la altura de sus
ojos.
CONCLUSION
Si dos cuerpos son da distinta sustancia
no existe relación entre
masa y volumen.
-
si tienen
masa iguales, tendrán distinto volumen,
-
- si tienen volúmenes
iguales, tendrán distinta masa.
Si dos cuerpos son de la misma sustancia, la masa y el volumen son proporcionales
- si tienen
masas iguales, tendrán
el mismo volumen,
-
si tienen
volúmenes iguales, tendrán masas iguales,
-
si tienen masas distintas, los volúmenes son tales que el cociente m/V se mantiene constante.
-
El volumen no indica la cantidad de
materia
DENSIDAD
Se denomina densidad
de un cuerpo al cociente entre la masa del mismo y su volumen.
La densidad indica la cantidad
de masa por cada unidad de volumen
![]()
Las unidades en las que se mide la densidad resultan de la fórmula, son
el cociente indicado entre las unidades de masa que se utilizan y las de
volumen.
LA DENSIDAD ES UNA PROPIEDAD QUE
DEPENDE DE LA SUSTANCIA Y NO DE LA CANTIDAD DE MATERIA
PROPIEDADES INTENSIVAS Y PROPIEDADES
EXTENSIVAS
Se llaman propiedades extensivas de una
sustancia a aquellas que dependen da
la masa, por ejemplo: peso,
volumen, largo, etc.
Se llaman propiedades intensivas de una sustancia a
aquellas que no dependen de la masa, por ejemplo, la densidad
Las propiedades intensivas no
permiten reconocer cada sustancia.
EJERCICIO
1) Dos
cuerpos que posean la misma masa puedan ser:
a) de la misma sustancia, b) de distinta
sustancia. c) No puede asegurarse nada acerca de la sustancia.
(elija la respuesta correcta)
2) Si Ud. desea determinar la
sustancia que conforma un cuerpo, ¿qué magnitud de las que se nombran a
continuación debe determinar?
a) el volumen
b)
la densidad
c)
la masa
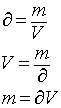
3) Elija le fórmula
que corresponda y resuelva los problemas:
a) La masa de un cuerpo es 100 g y su volumen es de 10 cm3. Cuál es su densidad?
b) ¿Cuál es la masa de un líquida contenido en una probeta si su densidad es 2,4 g/cm3 y su volumen 10 cm3,
c) Determine el volumen da un líquido de densidad 1,05 g /cm3 si tiene una masa de 0,5 g
|
"La más mínima partícula
de añadida al conjunto, aumenta la fuerza" Demóstenes |
CAPITULO CINCO
Fuerzas.
Concepto. Unidades de fuerza. Magnitudes escalares y vectoriales. La acción de
la gravedad. Peso.
T.P.N°6:
Dinamómetro.
T.P.N°7:
Peso específico.
FUERZA
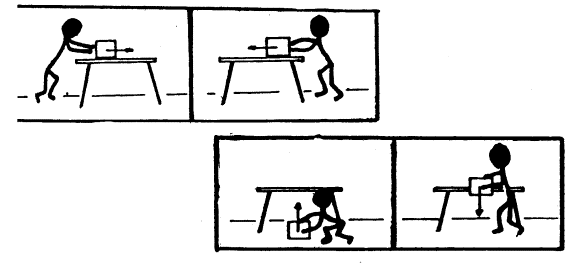
Como una primera definición de
fuerza diremos que es todo aquello capaz de alterar el estado de reposo de un
cuerpo, o de deformarlo , o de acelerarlo.
Si deseamos mover un cuerpo que está
sobre una mesa, podemos hacerlo hacia la derecha, hacia la izquierda, hacia
arriba, hacia abajo, etc (ver figuras)
Aún cuando apliquemos la misma
cantidad de fuerza el efecto final no es el mismo.
Es necesario determinar el sentido
en que se aplica la fuerza
Observamos que para medir la
longitud de un lápiz, por ejemplo, es indistinto que efectuemos la medición de
izquierda a derecha o viceversa. La longitud no varía
Sin embargo, cuando queremos abrir
una puerta le aplicamos una fuerza en un sentido contrario al que se le aplica
cuando se cierra. Así pues en una fuerza distinguimos:
DIRECCIÓN: recta de acción de la
fuerza
SENTIDO: uno de los dos sentidos de
la recta que incluye a la fuerza.
INTENSIDAD: cantidad de fuerza que
se aplica
PUNTO DE APLICACIÓN: punto dónde se
aplica la fuerza
Estos
elementos de una fuerza corresponden a la figura geométrica denominada VECTOR
(el vector es un segmento orientado según uno de los dos ordenamientos
naturales de la recta -dirección- en la que está incluído)
Por ello para representar fuerzas
utilizamos vectores
EJEMPLOS:
1.-
Representamos la fuerza F= 10
kgf en dos escalas diferentes. En el gráfico ambos vectores representan la
misma fuerza porque se han utilizado escalas distintas
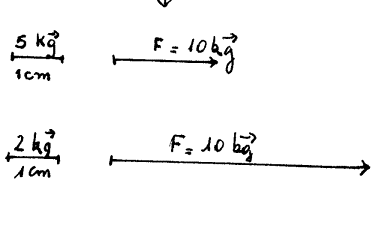
2.- Las
fuerzas F1 y F2 son distintas. Tienen distinta dirección
sentido e intensidad.
Calcule a partir del gráfico la
intensidad
3.- F3 y F4 tiene distinta intensidad y sentido pero la
misma dirección
Dos fuerzas si sus direcciones son
paralelas
F4 y F5 tienen
distinta intensidad, igual sentido e igual dirección
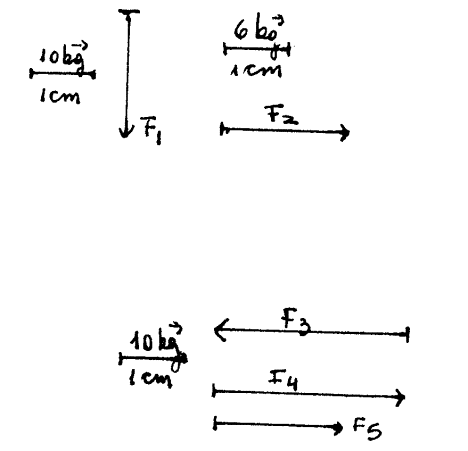
UNIDADES DE FUERZA
El sistema Internacional de Pesas y
Medidas adopta el Newton como unidad. La definición de Newton está ligada al
concepto de aceleración de la gravedad. Por
ello en el desarrollo que sigue continuaremos usando el kilogramo fuerza
(kf), aceptando que un kilogramo masa pesa un kilogramo fuerza
La equivalencia entre el kgf y el
Newton es:
1 kgf = 9,8 Nt
MAGNITUDES ESCALARES Y VECTORIALES
La masa, la longitud, la fuerza son
magnitudes pues para ellas podemos definir la igualdad y la suma, y establecer
una relación de orden, esto es lo que define las magnitudes. Existen dos tipos
de magnitudes
MAGNITUDES ESCALARES LAS QUE SE
DETERMINAN POR UN NÚMERO Y UNA UNIDAD DE MAGNITUD. Ejemplo la masa, la longitud, el tiempo, etc
MAGNITUDES VECTORIALES LAS QUE SE
DEFINEN MEDIANTE UN VECTOR. Ejemplo: la fuerza, la velocidad la aceleración,etc.
LA ACCION DE LA GRAVEDAD
Si soltamos un cuerpo, éste cae. Es
la Tierra la que lo atrae hacia sí. Esta propiedad de la Tierra se llama gravedad.
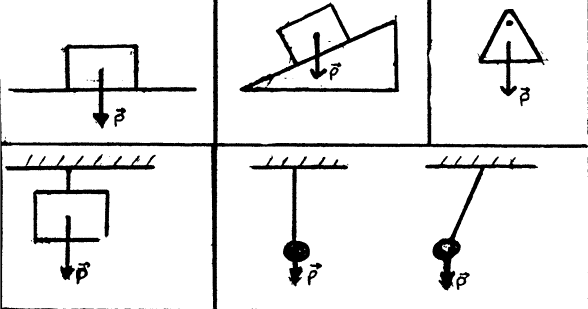
PESO
Se llama peso de un cuerpo a la fuerza con que es atraído por la Tierra.
El vector que representa a la fuerza peso tiene dirección perpendicular
la piso y sentido hacia abajo
Todos los cuerpos tienen atracción gravitatoria, (también las personas)
pero son los cuerpos de masa considerable los que poseen un campo gravitatorio
importante: El sol, los planetas, etc.

La gravedad terrestre varía en los distintos puntos de
la Tierra, es mayor en los polos que en el ecuador debido a la forma de la
Tierra.
La gravedad de la Luna es aproximadamente 10 veces menor que la gravedad
de la Tierra
|
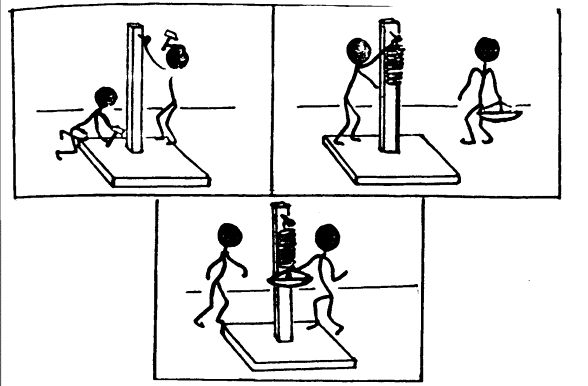
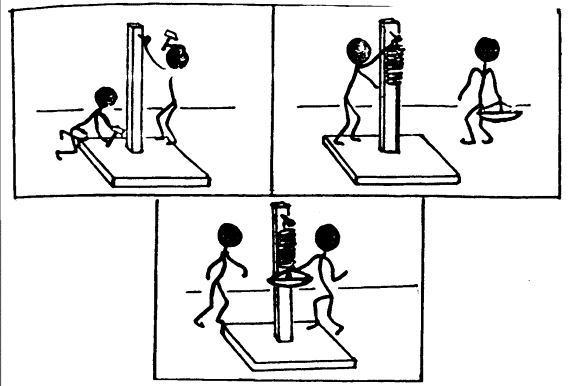
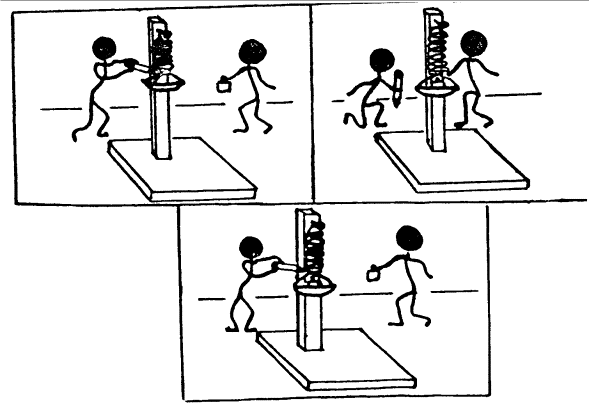
TRABAJO PRACTICO No 6 DINAMOMETRO OBJETIVO; Determinar la constante del resorte calibrado
en al T, P.N° 2. GUIA Elementos: Resorte calibrado
en el T.P,N° 2, regla graduada en Varios cuerpos de la misma sustancia (ejemplo: tuercas
y tornillos de hierro). Primera Parte: Determinar la
constante del resorte. - Medir la distancia de
cada marca al cero' confeccionar un - Graficar peso en
función del estiramiento, • Determinar la constante del gráfico. CONCLUSION ; El resorte calibrado
nos permite medir pesos, es un dinamómetro, La constante del resorte nos
sirve para determinar loa limitas de elasticidad del mismo, fuera de los cuales el resorte se rompe. Conocer la constante que nos permite además, hacer mejor las aproximaciones. |
|
|
TRABAJO PRACTICO No 7 PESO ESPECIFICO
OBJETIVO; Determinar el peso especifico
a)
- Mida los pesos de cada cuerpo de hierro y su volumen,
en forma experimental como se indica en si T.P.N0 3).
- Con los datos obtenidos construir un cuadro
|
peso (gf) |
volumen (cm3) |
|
• |
|
-Represente los datos el peso
en función del volumen.
-Determine la constante de
proporcionalidad.
b)
-Mida el peso y volumen da los cuerpos de distintas
sustancias. Confeccione un cuadro.
|
sustancia |
peso (gf) |
volumen (cm3) |
|
|
• |
|
-Grafique los datos. Observe
que entre peso y volumen de cuerpos de distinta sustancia no se puede
establecer una constante de proporcionalidad.
C)
- Mida el peso de la probeta vacía.
- Introduzca aceite en la
probeta hasta la primera marca de volumen. Pese la probeta con el aceite. Determine por diferencia
el peso del aceite.
- Agregue más aceite a
la probeta hasta la segunda marca y
pese.
- Repita el procedimiento hasta
llenar la probeta.
- Construya un cuadro con los
valores de peso y volumen como en el punto a).
- Grafique y determine la constante de
proporcionalidad.
CONCLUSION: El peso y el volumen
en cuerpos o porciones de materia de la misma sustancia son dos magnitudes
directamente proporcionales.
PESO ESPECIFICO
Si consideramos que el peso es
constante en un determinado lugar, o bien
tomamos un valor promedio de la aceleración de la gravedad,
podemos definir:
Se llama peso
específico de una sustancia que conforma
a un cuerpo al cociente
entre el peso del cuerpo y su volumen
El peso específico indica el
peso por cada unidad de volumen. No depende de la cantidad de sustancia
considerada, sino del tipo de sustancia.
Cada sustancia posee un peso específico que la
caracteriza
![]()
En símbolos:
Las unidades de peso específico son el cociente entre las
unidades de peso que se consideren
y las de volumen. En al T.P.N0 6 se ha determinado el paso
específico del hierro y de un aceite al
calcular la constante de proporcionalidad.
DIFERENCIA ENTRE MASA , PESO Y
VOLUMEN
MASA: Indica la cantidad de sustancia
que tiene un cuerpo. Se mantiene constante en los fenómenos físicos y químicos.
Es una magnitud escalar
PESO: Indica la fuerza con que
Tierra atrae a los cuerpos. Varía en los distintos puntos de la Tierra y el
sistema solar. No varía en fenómenos físicos y químicos. Es una magnitud
vectorial
VOLUMEN: indica el espacio que ocupa
una porción de materia. Es una magnitud escalar. Varía con la temperatura y la
presión
EJERCICIOS
1)
Grafique una
fuerza peso de 20 kg,, con dirección formando un ángulo de 30° con la
horizontal, sentido hacia la derecha.
2)
Represente
las fuerzas que se indican en el esquema, usando la misma escala para todo el
sistema
F1 = 30kgf , horizontal hacia la derecha
F2 = 45 kgf, forma un ángulo de 30° , en sentido contrario a
las agujas del reloj con F1; sentido hacia la derecha
F3 = 60 kgf forma un ángulo de 100°, en el sentido contrario a
las agujas del reloj con F2, orientación hacia la izquierda
3)
Se han
realizado las mediciones del peso específico de una sustancia y se han obtenido
los datos de la tabla. Calcule el peso específico más probable
|
Peso Específico (gf/cm3) |
10,3 |
10,34 |
10,36 |
10,37 |
10,38 |
|
Frecuencia |
10 |
20 |
50 |
70 |
10 |
4)
Elija la
ecuación que corresponda y resuelva los problemas:
![]()
Ø Calcule el peso específico de
un cuerpo que pesa 200 kgf y cuyo
volumen es de 14dm3
Ø Calcule el peso de un cuerpo
de peso específico 7,3 gf/cm3 y cuyo volumen es de 10 cm3
Ø ¿Cuál es el volumen de un
cuerpo de peso específico 11,2 gf/cm3 que pesa 100 gf
5)
Se tienen
los cuerpos A, B, C, D:
A Y C tienen el mismo volumen
A Y B tienen la misma masa
A Y D tienen el mismo peso específico
B y D tienen igual masa e igual volumen
¿Cuáles de las siguientes afirmaciones son verdaderas?
a)
A y C son de la misma sustancia
b)
A y B son de
la misma sustancia
c)
El volumen
de A, de B y de D son iguales
|
"Aguas profundas on las palabras de la boca de
hombre y arroyo que rebosa, la fuente de la sabiduría" Prov. 18-4 |
CAPITULO SEIS
El
agua. Ciclo del agua. Importancia. Estados de agregación. Características.
T.P.N°8:
Cambios de estado.
Cambios
de estado. Calor y temperatura. Densidad y temperatura.
Ejercicios:
El agua ocupa aproximadamente el 70% de la
superficie terrestre, con su acción erosiva produce constantemente cambios en
la corteza terrestre y es absolutamente imprescindible pata el desarrollo
vegetal y animal, es decir la
existencia de vida
Es una sustancia compuesta que se presenta en la Naturaleza en los tres
estados de agregación de la materia: sólido, líquido y vapor
El agua en la Naturaleza cumple un ciclo: Los
rayos del sol evaporan el agua de los ríos, mares, la nieve, la transpiración
de los animales, etc. El agua evaporada asciende y se condensa formando las nubes. El agua regresa a la superficie
terrestre con las lluvias, las nevadas
y el granizo.

El agua es una sustancia compuesta, ello
significa que su molécula está compuesta por átomos distintos, dos átomos de
hidrógeno y un átomo de oxígeno, y se representa en símbolos químicos: H2O
El agua no aparece en la Naturaleza,
químicamente pura sino que tiene disueltas en ellas algunas sales. Cuando se
destila el agua se la obtiene químicamente pura.
El agua potable es la que utilizamos para el
consumo, es apta para la vida no es tampoco químicamente pura porque los
organismos necesitan algunas de las sales que el agua posee.
Son varios los criterios que se utilizan para
considerar el agua potable, entre otros se pide que sea incolora, inodora e
insípida, no forme grumos con el jabón, no contenga gérmenes patógenos
En Argentinas es la Empresa Aguas Argentinas
quien se encarga de la potabilización del agua que consumen algunas ciudades.
En las zonas industrializadas se han contaminado
las aguas de las primeras napas y de
los ríos aledaños pues el avance tecnológico no ha tenido en cuenta el
procesamiento de los desechos industriales. En muchos casos, el hombre no ha
respetado el equilibrio ecológico y ha destruido el medio, provocando además de
la contaminación y por efecto de ésta, la desaparición de especies vegetales y
animales, la incidencia de enfermedades. Es responsabilidad de todos preservar
la Naturaleza si no deseamos convertirla en un arma mortal y hacer inhabitable
el planeta
ESTADOS DE AGREGACIÓN
Las
sustancias se presentan en estado sólido, liquido y gaseoso a temperatura y
presión ambiente, pero variando las condiciones de presión y temperatura pueden
cambiar de estado.
CARACTERÍSTICAS DE LOS ESTADOS
DE AGREGACIÓN
SOLIDO: Tienen forma y volumen
definidos son muy poco compresibles
LIQUIDOS: tienen volumen definido,
pero adquieren la forma del recipiente que los contiene
GASES no tienen volumen ni forma
definidos, ocupan todo el recipiente que los contiene. Son muy compresibles.
Estas características y otras se explican por la
teoría del espacio intermolecular o camino libre medio de las moléculas. En los
sólidos la cohesión entre las moléculas es mayor que en los líquidos y en los
gases. El camino libre medio no permite que las moléculas adquieran energía
cinética )de movimiento) apreciable,, lo que los hace apenas compresibles.
El camino libre medio es mayor en los fluidos
(líquidos y gases) por lo que sus moléculas tienen mayor energía cinética. En
los gases la energía cinética es muy grandes y las moléculas están en constante
movimiento produciendo entre sí choques elásticos constantes.
TRABAJO PRACTICO N°
8
CAMBIOS DE ESTADO
OBJETIVO: Verificar que la
temperatura se mantiene constante cuando una sustancia pasa de un estado a
otro.
GUIA
-
Coloque
en un vaso de precipitados un poco de hielo, entre los cubos de hielo coloque
un termómetro graduado de '10 ° a 150°. Anote la temperatura
-
Arme
un dispositivo como indica la figura.
En el balón coloque agua, el termómetro no debe estar dentro del
líquido. Cuando el agua comience a hervir anote la temperatura

CONCLUSIÓN: DURANTE LA FUSIÓN EL
TERMÓMETRO MARCA 0°
DURANTE LA EBULLICIÓN EL
TERMÓMETRO MARCA 100°
CAMBIOS DE ESTADO
Observamos
que al comenzar a calentar el agua, la columna de mercurio del termómetro
empezó a ascender; pero durante la ebullición, aunque seguimos entregando calor
la temperatura permanece constante. El calor entregado no es usado por el agua
para aumentar su temperatura, sino para incrementar la energía cinética de sus
moléculas y pasar al otro estado.
EXPERIENCIA: Coloque en un recipiente 100 cm3 de
agua y en otro 200cm3 de agua y mida la temperatura de ebullición.
Cuando una sustancia pasa de un estado a otro la
temperatura se mantiene constante, se llama punto fijo de cambio de estado y
depende de la sustancia, no de la masa
Los puntos fijos son propiedades intensivas.
Cada cambio de estado recibe un nombre
FUSIÓN de sólido a líquido
SOLIDIFICACIÓN: de líquido a sólido
SUBLIMACIÓN de gaseoso a sólido
VOLATILIZACIÓN: de sólido a gaseosos
VAPORIZACIÓN de líquido a gas
LIQUEFACIÓN: de gas a líquido
Así se nombran los puntos fijos: punto de
fusión: cuando el sólido se está fundiendo: punto de liquefacción cuando el gas
se licúa
CALOR Y TEMPERATURA
Nuestro
sentido del tacto nos permite distinguir el estado térmico de los cuerpos. Pero
la apreciación sensorial es relativa pues depende de nuestro propio estado
térmico. Si tenemos las manos frías el agua a temperatura ambiente nos parecerá
más calientes que cuando nuestras manos no están frías. Cuando nos sumergimos
en una piscina después de tomar sol el agua nos dará una sensación de frío distinta
a la que tienen otros.}
El estado térmico de un cuerpo no es una
magnitud física pues no puede definirse la suma de dos estados térmicos.
Pero sí pueden compararse dos estados
térmicos: Para ello se utilizan los
termómetros
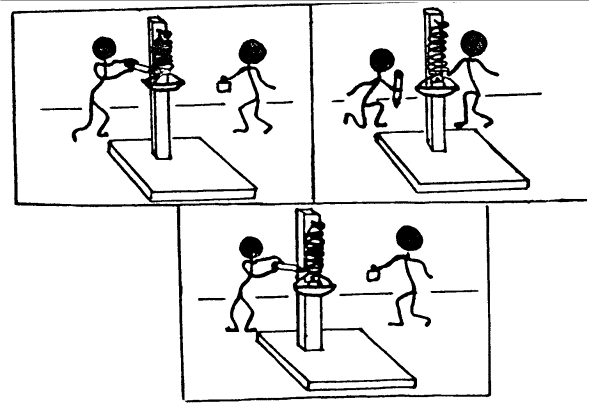
El termómetro se basa en el siguiente principio:
El tubo de la figura es un tubo capilar que termina en un bulbo. Se coloca
mercurio en su interior. Al sumergir el bulbo
en los vapores de agua en ebullición el mercurio se dilata por efecto del calor y sube por el tubo. Si
lo introducimos en vapores de alcohol , también se dilatará pero menos que en
el agua.
Tomando un punto como referencia se pueden
compara los estados térmicos. A cada
estado térmico se denomina TEMPERATURA
La temperatura se mide en diversas escalas
Escala Celcius, grados centígrados, asigna el 0
al punto de fusión del agua y el 100 al punto de ebullición del agua
La escala Reamur asigna el cero al punto de
fusión del agua, pero a su punto de ebullición asigna el número 80.
Para temperaturas inferiores a -39° punto de
solidificación del Mercurio, se utilizan otros líquidos, por ejemplo alcoholes;
para temperaturas mayores a 300° punto de ebullición del Mercurio se utilizan
otro tipo de termómetros que pueden ser, por ejemplo a gas, eléctricos, etc.
DENSIDAD Y TEMPERATURA
El
aumento de temperatura produce en los cuerpos una dilatación, es decir un
aumento de volumen. Se dice que la dilatación es lineal cuando el aumento de
volumen es mayor longitudinalmente ( como en el caso del tubo capilar que
contiene el mercurio en el caso anterior): la dilatación es superficial cuando
se produce en dos dimensiones,(largo y ancho( y cúbica si se produce en las
tres dimensiones.
Hemos
visto que para determinar la densidad de un cuerpo se divide su masa por su
volumen, por lo tanto cuando varía la temperatura, varía la densidad.
La densidad es una propiedad intensiva que
caracteriza a cada sustancia a una temperatura determinada. En las tablas de
densidad siempre se indica a qué temperatura fueron calculadas
EJERCICIO
Responda
Verdadero Falso según corresponda:
1)
Cuando una
sustancia pasa de un estado de agregación a otro se produce un fenómeno químico
2)
Las
moléculas de los sólidos tienen mayor camino libre medio que las de los gases
3)
El calor y
la temperatura son la misma magnitud
4)
La densidad
es una propiedad intensiva.
5)
La densidad
varía con la temperatura porque varía la masa
6)
El
termómetro mide variación de estados térmicos
7)
La densidad
del agua es mayor que la densidad del aceite
8)
Cuando una
sustancia pasa de un estado de agregación a otro la temperatura de cambio de
estado se mantiene
9)
Los puntos
fijos son una propiedad intensiva
|
El Orinoco, olas leonadas. El Guananía, olas Negra. En
el corazón de la selva los ríos se reúnen, más por largo trecho corren sin
mezclarse, conservando cada uno su peculiar coloración |
CAPITULO
SIETE
Sistemas
materiales. Clasificación. Fases. Sistemas heterogéneos. Métodos de separación.
T.P.N°9:Sistemas
materiales heterogéneos. Sistemas homogéneos. Soluciones: Soluciones saturadas.
T.P.N°10:
Sistemas homogéneos.
Curvas de
solubilidad.
Ejercicios.
Una playa vista a distancia nos parece una
superficie lisa y uniforme pero al acercarnos y levantar un puñado de arena,
encontramos además de ella, restos de caracoles, almejas, etc..
Del mismo modo, un vaso con agua colocado al
lado de un vaso con agua y sal, no tiene diferencia aparente. Pero si
entregamos calor, hasta la ebullición total del agua, observaremos las
diferencias
Si deseamos estudiar la Naturaleza nos es
imposible considerar el universo en su totalidad, cada vez. Es necesario
aislar, real o imaginariamente la parte de la materia que vamos a analizar
SISTEMA MATERIAL: Se llama así a toda porción de
materia que se considera aislada del resto para analizar sus propiedades.
Determinado el sistema material a estudiar,
interesa observar si existen distintas partes en él.
Puede
ser que a simple vista el sistema parezca como un todo, pero al ser observado
con un microscopio u ultramicroscopio muestre partes distintas bien
delimitadas.
Se
denomina FASE DE UN SISTEMA MATERIAL A TODA PORCIÓN DEL SISTEMA CON LAS MISMAS
PROPIEDADES INTENSIVAS
|
CLASIFICACION DE LOS
SISTEMAS MATERIALES |
|
|
Sistemas homogéneos: tienen una sola fase |
Sistemas heterogéneos tienen más de una fase |
|
Ejemplos
: Agua y sal Nafta y aceite |
Ejemplos: agua y aceite Arena y agua |
Entre los sistemas heterogéneos se encuentran
los coloides cuyas fases son percibidas únicamente al ultramicroscopio. Ej.
Clara de huevo.
Una fase de un sistema puede estar formada por
más de una sustancia.
Cuando dos o más sustancias forman una fase no
cambian sus propiedades, diremos que se han mezclado.
METODOS DE SEPARACIÓN DE SISTEMAS HETEROGÉNEOS.
Los sistemas heterogéneos poseen más de una
fase. Analizaremos algunos métodos físicos de separación:
IMANTACIÓN: Se utiliza cuando una de las fases
es hierro. Ej.: limaduras de hierro y arena
TAMIZACIÓN: Se utiliza para separar dos sólidos
de distinta granulación EJ. Piedras y arena
DECANTACIÓN: Se utiliza para separar dos líquidos
de distinta densidad no miscibles. EJ: agua y aceite
FILTRACIÓN: Se utiliza para separar un líquido
de un sólido: Ej.: arena y agua.
EJEMPLO:
El
sistema formado por agua, alcohol, arena y limaduras
de hierro, es un sistema heterogéneo de tres fases:
Ø
Agua y
alcohol
Ø
Arena
Ø
Limaduras de
hierro
Este sistema está compuesto por cuatro sustancias
Para separar el sistema, procedemos así:
Ø
Filtramos
las limaduras y la arena
Ø
Luego por
imantación separamos las limaduras de la arena.

El agua y el alcohol forman un
sistema homogéneo que no es posible separar por los métodos descriptos para los
sistemas heterogéneos
|
TRABAJO PRACTICO n° 9 SISTEMAS MATERIALES
HETEROGÉNEOS OBJETIVO: Separar fases de
sistemas heterogéneos GUÍA: Elementos de laboratorio:
imán, papel de filtro, embudo, vasos de precipitados, tamiz, ampolla de
decantación SISTEMA 1: Limaduras de
hierro, arena SISTEMA 2: Aceite, agua SISTEMA 3: Arena , agua y
sal de cocina SISTEMA 4: Harina , sal
gruesa SISTEMA 5: Agua, Hielo Indique en caso el número de
fases y sustancias que conforman el sistema. Describa el método que emplea
para separar fases CONCLUSIÓN: Al separar las
fases de un sistema heterogéneo, se obtienen sustancias o bien, sistemas
homogéneos |
SISTEMAS HOMOGÉNEOS
Para
separar los sistemas homogéneos se utilizan métodos de fraccionamiento como la
destilación y la cristalización.
En la figura se presenta el dispositivo
utilizado para la destilación. En el
balón de la izquierda se coloca, por ejemplo, agua y cloruro de sodio (sal
común) disuelta en ella. (Puede usarse dicromato de potasio para obtener una
solución coloreada)
Al calentar la solución agua-sal, el agua
entrará en ebullición cuando el termómetro marque 100°C. Los vapores de agua
que pasan a través del tubo delgado del refrigerante y se condensan al
enfriarse, por efecto del agua que circula alrededor del tubo interior. Las
gotas de agua caen en el erlenmeyer de la derecha.
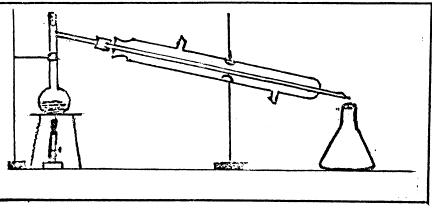
Al final del proceso, quedarán
en el balón los cristales de sal y en el erlenmeyer el agua,
Si repetimos la destilación, con el agua
obtenida en el erlenmeyer, observaremos al finalizar el procesos que en el
balón no hay ninguna sustancia.
Diremos entonces que un sistema homogéneo es
Ø
Una solución si puede fraccionarse en más
de una sustancia
Ø
Una sustancia pura si no puede fraccionarse
en otras sustancias.
SOLUCIONES
Las sustancias que intervienen en una solución
pueden estar en cualquiera de los estados de agregación de la materia.
Tendremos así, soluciones:
v
Sólido - sólido: ejemplo, las aleaciones, las
amalgamas
v
Sólido - líquido: ejemplo, agua
- azúcar. En estas soluciones el líquido se llama solvente o
disolvente. El sólido se llama soluto
v
Gas - líquido: ejemplo las bebidas gaseosas
v
Gas - gas: ejemplo el aire.
COMPOSICIÓN DE LOS SISTEMAS
MATERIALES
Las sustancia que conforman un sistema
heterogéneo pueden estar en cualquier proporción.
Lo mismo ocurre en las soluciones gas -
gas. Pero en las soluciones sólido -
líquido, la cantidad de soluto que puede disolverse depende, entre otras
variables, de la temperatura..
A una temperatura determinada, una cantidad de
solvente disolverá una cierta cantidad de soluto y no más. Si se agrega mayor
cantidad de soluto éste se deposita en el fondo. El solvente siempre se
encuentra en mayor proporción que el soluto.
Se llama concentración
de una solución a la masa disuelta en una cantidad fija de masa o volumen de solvente o de solución.
Por ejemplo, se disuelven 12 gramos de sal en 40
gramos de agua, mediante una regla de
tres simple podemos determinar que la concentración es de 30 gramos/100 gramos
de agua.
Se llama solución
saturada a una temperatura dada aquella que no puede disolver más soluto a
esa temperatura y se encuentra en equilibrio con un exceso de soluto sólido.
Si a una solución saturada a una temperatura
dada se le hace descender lentamente la
temperatura, el soluto en exceso no desciende. En este caso obtenemos una
solución sobresaturada en la nueva temperatura. Las soluciones sobresaturadas
son inestables, basta que se agregue un cristal de sal o un simple movimiento
para que el soluto en exceso se deposite en el fondo del recipiente
|
TRABAJO PRÁCTICO N° 10 SISTEMAS HOMOGÉNEOS OBJETIVOS :Verificar el
principio de la destilación Verificar que la solubilidad aumenta con
la temperatura GUÍA: 1) En 150 cm3 de
agua agregar una cucharada de sal común agitando hasta que toda la sal se
disuelva . Calentar la solución harta que comience la ebullición, recoger en
una placa de meta o en una cuchara los vapores. Cuando el vapor se condense
en la placa, pruebe el líquido (ver dibujo) 2) Disuelva 50 gr.
de azúcar en 100 cm3 de agua, caliente lentamente hasta que toda el azúcar se
disuelva. Luego vuelva a enfriar hasta dos o tres grados. 3) En 250 cm3 de
agua mezcle 90 gr. de sal común. Caliente lentamente hasta que toda la sal se disuelva. Retire la
solución del mechero. Coloque el termómetro en la solución. Cuando cristalice
mida la temperatura
|
CURVAS DE SOLUBILIDAD
Representamos la solubilidad en función de la
temperatura para el nitrato de potasio.
En la tabla la solubilidad se expresa en gr. De
sal/100 gr.de agua
La temperatura se expresa en grados centígrados.
Si grafica los datos podrá observar que la solubilidad no es proporcional a la
temperatura.
|
Nitrato de potasio |
|
|
Temperatura °C |
Solubilidad Gr.sal/100agua |
|
0 |
13.122 |
|
10 |
21.50 |
|
20 |
31.75 |
|
30 |
45.98 |
|
40 |
64.603 |
|
50 |
85.87 |
EJERCICIOS
1)
Las
siguientes son las respuestas de un alumno a una evaluación de cinco pregunta
a)
1) Un sistema heterogéneo está
formado por una sola fase
2)
El sistema del ejemplo es un
sistema homogéneo
b)
Si un sistema es homogéneo se
trata de una sustancia pura
c)
Para separar una solución
pueden utilizarse distinto métodos, por ejemplo, la decantación
d)
En un solución saturada está disuelto el máximo de
soluto que se puede disolver a una temperatura dad
e)
Si se aumenta la temperatura
entonces se puede agregar más soluto
La profesora asignó dos puntos a cada pregunta. ¿Qué calificación obtuvo
el alumno?. ¿Puede Ud. inferir cual fue el cuestionario? ¿Puede Ud. decir si el
sistema dado como ejemplo en el punto a-2 de la evaluación era homogéneo o
heterogéneo? ¿Por qué?
3)
ROMPECABEZAS
DE LETRAS
En cada casillero se coloca sólo una letra. las palabras se forman el
orden de las flechas pero no necesariamente en el orden en que se dan las
referencias
Referencias
1)
Método para
separar sistemas homogéneos./ método de separación de sistemas heterogéneos de
dos fases líquidas de distinta densidad
2)
Constante
que indica la cantidad de soluto que se disuelve en un liquido a una
temperatura determinada./ Sistema homogéneo compuesto por dos sustancias. /
Sólido que se disuelve en un líquido./ Disolvente.
3)
Sistema
material de más de una fase
4)
Sistema
material monofásico.
5)
Parte de un
sistema material con las mismas propiedades intensivas.

|
El sinfín rueda eternamente hacia el sin fondo. Víctor
Hugo |
CAPITULO OCHO
Presión.
Concepto unidades. Presión hidrostática. Presión ejercida por los gases. El
aire. La presión atmosférica. Variaciones de la presión atmosférica y su
influencia en los puntos fijos.
T.P.N°11:Presión
atmosférica. El aire.
Condiciones
de presión y temperatura de un sistema material. Transformaciones físicas.
Conservación de la masa en las transformaciones físicas.
Ejercicios.
PRESION
La figura nos muestra un cuerpo colocado sobre un colchón de gomaespuma,
en tres posiciones distintas: la única fuerza que se ejerce sobre el colchón es
el peso del cuerpo, sin embargo, en cada posición se verifica una deformación
distinta. Esto se produce porque la superficie de apoyo del cuerpo varía
Llamaremos PRESIÓN a la fuerza
aplicada por unidad de superficie.
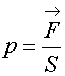
La presión de una fuerza sobre
una superficie se calcula mediante la fórmula:
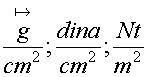
Algunas de las unidades de
medida de la presión son:
PRESION HIDROSTATICA
En el aparato del figura S1
y S2 son las secciones transversales de
los émbolo. Dentro del
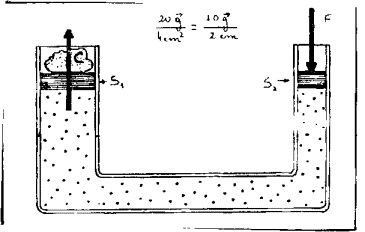
recipiente hay un líquido
.
Si S1 = 4 cm2, S2 = 2
cm2 y el peso del cuerpo es C = 20 gf, se determina experimentalmente que para
mantener el equilibrio, evitando que el émbolo 1 ascienda, hay que aplicar
sobre éste una fuerza de 10gf.
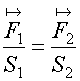
En general:
PRESIÓN EJERCIDA POR LOS
GASES: EL AIRE. LA PRESIÓN ATMOSFÉRICA
Los gases, como los líquidos, transmiten presiones.
EXPERIENCIA: En un recipiente de latón colocamos un tapón de goma de modo
que cierre perfectamente la boca del recipiente al ser apoyado sobre ella.
Calentamos el recipiente tapado, observaremos que el tapón sale
despedido.
Sabemos que las moléculas del gas tienen una gran energía cinética y
están produciendo entes sí constantemente choques elásticos. Al calentar el
gas, las moléculas adquieren mayor velocidad, ejerciendo una presión mayor
sobre las paredes del recipiente: El
aumento de la presión interior es lo que hace saltar el tapón
EL AIRE
El aire es una solución de gases: nitrógeno, oxígeno, dióxido de carbono
y gases raros.
El gas que se encuentra en mayor proporción es el Nitrógeno cuya función
es diluir el oxígeno y evitar las combustiones violentas. El oxígeno es
necesario para la respiración y permite la combustión.
La masa de aire que rodea la
Tierra se llama atmósfera .
La ATMÓSFERA está dentro del campo gravitatorio terrestre, por lo pata,
PESA. Ese peso ejerce sobre los cuerpos una presión que se llama PRESIÓN
ATMOSFÉRICA.
Para demostrar la existencia de la presión atmosférica, puede realizarse
la siguiente experiencia. Introduzca agua en una pipeta, o bombilla o sorbete y
tape rápidamente un extremo. El agua no caerá. Destape el extremo. El agua cae.
La existencia de la presión atmosférica era conocida desde la antigüedad.
El primero en medirla fue Evangelista Torricelli en 1643. A temperatura
ambiente y a nivel del mar, realizó la siguiente experiencia:
Ø Llenó un tubo de aproximadamente un metro de largo,
con mercurio
Ø Colocó el tubo invertido en
una cubeta también llena con mercurio
Ø Observó que el mercurio
del tubo descendía hasta que la columna
alcanzaba una altura de 75 cm
Ø Concluyó: Sobre la cubeta actúa la presión atmosférica, dentro del tubo el
mercurio produce una presión hidrostática. El mercurio desciende hasta que la
presión hidrostática iguala a la presión atmosférica
El valor de la presión atmosférica se calcula así:
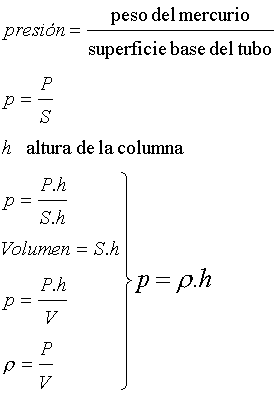
En la base inferior del tubo
la presión p, es:
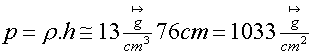
En consecuencia la presión
ejercida por la columna de mercurio es:
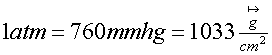
Otras unidades de presión
atmosférica:
INFLUENCIA DE LA PRESIÓN EN LOS PUNTOS FIJOS
El aparato de la figura fue utilizado por Kelvin para demostrar que la
presión hacer varia los puntos fijos
El pistón del extremo permite aumentar la presión.Se observa que la
temperatura de fusión cambia.
AL DETERMINAR LOS PUNTOS FIJOS DE UNA SUSTANCIAS HAY QUE INDICAR LAS
CONDICIONES DE PRESION con las que se está trabajando.
|
TRABAJO PRACTICO
N° 11 PRESIÓN ATMOSFÉRICA - EL AIRE OBJETIVO: 1 ) Verificar la existencia de la presión atmosférica. . 2) Determinar el porcentaje da oxígeno en el aire. 1) — Llenar un vaso con
agua , colocar un papel sobre la
boca del vaso [cuidar de que no queda aire en el vaso), Colocar el vaso boca abajo, -
En una botella de boca ancha [de aceite, por ejemplo) colocar un huevo duro sobre la boca da la
botella, da modo que encaje perfectamente pero que no caiga
dentro de la misma. Sacar el huevo, a introducir
dentro de la botella un algodón empapado de alcohol, -
Encender el algodón y tapar rápidamente la botella con
el huevo.
2) - Colocar un plato
hondo una vela pegada al mismo. -
Agregar agua coloreada con tinta China -
Colocar un vaso invertido sobre la vela apagada, medir
la al altura de agua en el vaso. -
Levantar el vaso prender
la vela. Rápidamente, en un solo movimiento, sin apagar la vela, colocar el
vaso invertido sobre ella. -
Cuando la vela se apaga, y el humo blanco que forma ha
descendido, marcar la altura de agua en al vaso, Cálculo del porcentaje de oxigeno en al aire. Antes de prender la vela, la primera marca que se hace en el vaso corresponde al volumen de aire en el vaso
(restándole el volumen que ocupa la vela) El volumen de agua que entra en el vaso cuando la vela se apaga corresponde aproximadamente al volumen de oxígeno consumido, que es todo el
oxígeno que había dentro del vaso. Para medir los dos volúmenes utilizamos una
probeta y una pipeta. El porcentaje de oxígeno obtenido es aproximado |
CONDICIONES DE PRESION Y TEMPERATURA DE UN SISTEMA
MATERIAL
Para clasificar un sistema material debemos
tener en cuenta la presión y la temperatura que intervienen. Hemos definido
fase de un sistema material como todos los puntos del sistema que poseen las
mismas propiedades intensivas, como la densidad y los puntos fijos. La
presión y la temperatura inciden sobre
el volumen y los puntos fijos. Por ejemplo, un vaso conteniendo agua líquida y
agua sólida a temperatura ambiente es un sistema heterogéneo, pero después de
un tiempo, el hielo pasa al estado líquido
TRANSFORMACIONES FISICAS
Se denominan transformaciones físicas a aquellas
en las que no hay cambio de sustancia (cambios de estado, separación de
sistemas, movimientos, etc.)
Se comprueba experimentalmente que:
EN TODA TRANSFORMACIÓN FISICA
LA MASA SE MANTIENE CONSTANTE
EXPERIENCIA
Ø
Determine la
masa de un sistema agua sólida - vaso . Caliente el sistema hasta que el agua
pase al estado líquido sin entrar en ebullición. Determine la masa del sistema
agua líquida-vaso
Ø
Determine la
masa del sistema limaduras de hierro - arena seca. Separe el sistema. Determine la masa de cada fase. Compare con la
masa anterior
EJERCICIOS
1)
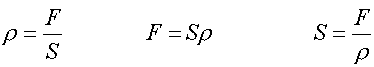
Resuelva los siguientes
problemas eligiendo la fórmula que convenga:
a)
Calcule la
presión producida por una fuerza F= 10 kgf, aplicada sobre una superficie de 6m2
b)
¿ Cuál es la
fuerza que produce una presión de 0,6 grf/cm2 al ser aplicada sobre
una superficie de 10 cm2?
c)
¿Sobre qué
superficie se aplicó una fuerza de 3 gf, si produjo una presión de 0,2 gf/cm2?
2)
Coloque
verdadero o falso según corresponda
|
La presión es una magnitud escalar |
|
|
Las unidades de presión sonunidades derivadas |
|
|
El oxígeno es el gas que se encuentra en mayor
proporción en el aire |
|
|
La presión atmosférica aumenta cerca del nivel del mar |
|
|
En una transformación física hau cambio de
sustancia |
|
|
En una transformación física la masa varía |
|
3)EXPERIENCIA
OBJETIVO: Verificar el efecto de la presión en
los puntos fijos
(advertencia: realizar con cuidado)
Elementos: erlenmeyer, dos tubos de vidrio
cortos insertados en un tapón para el erlemeyer; dos mangueras; una jeringa, un
broche, agarradera, soportes, mechero
Ø
Sujete la
jeringa, verticalmente en un soporte de modo que el émbolo quede hacia arriba
Ø
Coloque un
tope sobre la jeringa a una distancia un poco menor que el máximo
desplazamiento del émbolo.
Ø
Conecte una manguera al extremo de la jeringa
Ø
Coloque agua
en el erlenmeyer, tápelo con el corcho preparado.
Ø
Conecte la
manguera de la jeringa a uno de los tubos del tapón
Ø
Conecte la
otra manguera al otro tubo dejando libre el otro extremo
Ø
Caliente el
agua hasta que comience la ebullición
Ø
Estrangule
con el broche la segunda manguera. Retire inmediatamente el mechero
Ø
Baje y suba
el émbolo de la jeringa, manteniendo estrangulada la otra manguera. Observe el
agua
|
Comparado con el universo el
hombre es menos que un átomo. Pero, el hombre piensa, puede reir, puede amar |
CAPITULO NUEVE
Sustancias
puras. Simples y compuestas. El átomo: Modelo atómico moderno. Tabla periódica
moderna. Peso atómico. Uniones químicas.
T.P.N°12:Conservación
de la masa. Obtención de oxigeno
Conservación
de la masa: formulas y ecuaciones.
SUSTANCIAS PURAS
Cuando un sistema material homogéneo se somete a un método de
fraccionamiento, por ejemplo , se destila y al final del proceso se obtiene la
fase inicial, entonces el sistema está formado por una sustancias pura
Las sustancias puras se descomponen mediante reacciones químicas y pueden
dar origen a otras sustancias o no.
Ø De la descomposición química
del agua se obtienen dos gases oxígeno e hidrógeno. El agua es una sustancia
compuesta. La molécula de agua contiene átomos distintos
Ø
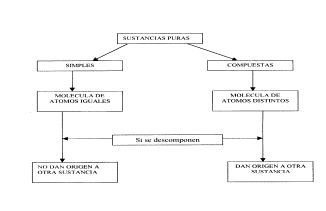
El oxígeno y el hidrógeno no
pueden descomponerse para dar lugar a otra sustancia. Se trata de sustancias
simples. Las moléculas de éstas contienen átomos iguales. Los átomos que caracterizan las sustancias
simples ( o sus variedades alotrópicas) se llaman elementos
EL ATOMO
Desde la antigüedad los hombres trataron de
explicar cómo estaba constituida la materia. Quien fue , probablemente el
primero en hablar de átomo, fue el griego Demócrito. Suponía que la materia
podía dividirse sucesivamente en partículas cada vez más pequeñas, hasta llegar
a un punto en que ya no era posible
dividirla más. Hoy llamamos molécula a los que Demócrito llamó átomo. A esa última partícula la llamó Demócrito ,
átomo. Pero también había otras teorías: Empedocles creía que toda la materia
estaba formada por cuatro elementos, agua,fuego, aire y tierra.
Durante años, como antecedente de la química
actúa, se desarrolló la alquimia. Los alquimistas experimentaban reacciones
químicas de las sustancias, con el objeto de trasmutar los metales en oro.
Aproximadamente en le siglo XVIII, es cuando la
química comienza su verdadero desarrollo. Los conceptos de sustancias simples y
compuestas y elemento eran ya parte del conocimiento. Y comenzaron a
desarrollarse los modelos atómicos
¿POR QUÉ MODELOS?
La constitución íntima de la materia no puede ser observada directamente
por el hombre. Este deber experimentar con cantidades de sustancia que pueda
manipular
Al construir un modelo, el científico se basa en las experiencias
realizadas y trata de explicar el comportamiento de las sustancias. Es como si
afirmara " Si la materia se comporta de este modo, debe tener esta
disposición"
En 1800, John Dalton
propone un modelo atómico de la materia, después de estudiar el comportamiento
en distintos gases:
-
la materia
está formada por partículas indivisibles llamadas átomos
-
todos los
átomos del mismo elemento son iguales
-
los átomos
de elementos distintos son distintos
Hacia fines del siglo XIX, los descubrimientos del electrón y la
radiactividad, exigieron que el modelo de Dalton fuera modificado
-
Ernest
Rutherford propone la teoría del átomo nuclear, que contenía una región
central, donde se concentra la masa del átomo y con carga eléctrica positiva
-
Niels Böhr,
sobre la base del modelo de Rutherford, propone: alrededor del núcleo giran los
electrones describiendo órbitas determinadas
El modelo actual, basado en el de Böhr, acepta que:
|
EL ATOMO SE COMPONE DE: -
NUCLEO: Donde se concentra la masa, contiene los PROTONES, partículas
con carga positiva y los NEUTRONES, Partículas con sin carga eléctrica -
Los ELECTRONES partículas de masa despreciable comparada con la del
núcleo y que poseen carga eléctrica
negativa -
Los electrones ocupan alrededor del núcleo ciertos niveles de energía
llamados ORBITALES, estos se representan como nubes de partículas Es decir, el orbital es una región del
espacio ,alrededor del núcleo donde es probable encontrar un electrón |
¿Por qué al tocar los cuerpos no notamos la
existencia de cargas eléctricas? Porque la materia es eléctricamente neutra, es
decir en el átomo existen la misma cantidad de protones que de neutrones. Sin
embargo, cuando los átomos intervienen en una combinación o descomposición
química, la reacción se efectúa a nivel de los electrones. Los átomos pueden
tomar o ceder electrones. En una reacción química los núcleos permanecen
invariantes, el número de protones no varía.
Se llama NUMERO ATÓMICO al número de protones de un átomo. En la Tabla
Periódica moderna el número atómico se usa para ordenar y clasificar los
elementos
TABLA PERIODICA DE LOS
ELEMENTOS
Todos los elementos conocidos se agrupan en la
Tabla Periódica de los elementos. A cada elemento se le hace corresponder un
símbolo, que hace universal el lenguaje de la química y facilita la expresión
de las moléculas y las reacciones químicas
EJEMPLOS:
O : ÁTOMO DE OXÍGENO
O2: MOLÉCULA DE OXÍGENO, posee dos átomos iguales,
es una sustancia simple
O3 MOLÉCULA
DE OZONO ,inestable, posee tres átomos de oxígeno, es una sustancia simple
H2O: MOLÉCULA DE AGUA, posee dos átomos de hidrógeno (H) y un átomos de oxígeno (O), es
una sustancia compuesta.
La tabla periódica moderna consta de 8 grupos, y de 18 columna que
determinan los subgrupos A y B. Las columnas que corresponden al subgrupo A son
siete, las dos primeras de la izquierda y de la columna 13 a la 17 de la
derecha. La última columna de la derecha corresponde al grupo de los gases
raros o inertes
Las columnas que corresponden al subgrupo B, son diez; de la tercera a la
séptima corresponden a los grupos 3 al 7 respectivamente, de la décima a la
octava inclusive pertenecen al grupo 8,
la undécima y duodécima corresponden , respectivamente a los subgrupos
1B y 2B
Los grupos reúnen a los elementos de la misma familia, es decir con
propiedades químicas similares. Tienen la misma cantidad de electrones en la
última órbita
La tabla consta de 7 períodos, los que se establecen a partir de la
configuración electrónica de los elementos (la expresión "configuración
electrónica" se utiliza para referirse a la distribución de los electrones
en los distintos niveles de energía)
PESO ATÓMICO RELATIVO
Al intentar determinar la masa del átomo, el patrón establecido como
unidad de masa, el kilogramo masa patrón, no resultó útil pues la masa del
átomo es muy pequeña. Fue necesario entonces, fijar un nuevo patrón para las
masas atómicas. En principio se tomó como patrón el átomo de
Hidrógeno, pero actualmente se utiliza el átomo de carbono
La masa atómica, o el peso
atómico, de cada elemento figura en la tabla periódica.
Por ejemplo: Si tomamos como patón el hidrógeno, cuyo peso atómico según
nos indica la tabla es 1, el oxígeno cuyo peso atómico es 32 tendrá una masa atómica 32 veces mayor que
la del hidrógeno.
CLASIFICACION DE LOS ELEMENTOS DE LA TABLA PERIÓDICA
METALES
-
Se
encuentran a la izquierda de la tabla
-
Tienen
brillo metálico
-
Son buenos
conductores del calor y la electricidad
-
Son casi
todos sólidos a temperatura ambiente,
excepto el mercurio
NO METALES
-
Se
encuentran a la derecha de la tabla periódica
-
Son malos
conductores del calor y la electricidad
-
Se presentan
en los tres estados de agregación de la materia
ELEMENTOS DE TRANSICIÓN
-
Son los
elementos que están en el subgrupo B, entre los grupos 3 y 2 inclusive. Presentan propiedades particulares, por
ejemplo el aluminio (Al) que es un metal en algunas combinaciones se comporta
como no metal
GASES INERTES
-
Pertenecen
al grupo 0. No intervienen en
reacciones químicas
NUMERO MÁSICO
De la tabla periódica obtenemos el número másico
aproximando el peso atómico a un número entero
EL NUMERO MASICO ES LA SUMA DEL NÚMERO DE
PROTONES Y EL NÚMERO DE NEUTRONES DEL ATOMO
Número másico = Número atómico + Numero de neutrones
Ejemplo:
De la tabla surge que el Número atómico (NA) del
Potasio (K) es 19 y su peso atómico (PA) es 39,1 entonces su número másico es
39
Luego
39 - 19= 20, el potasio tiene 20
protones
El núcleo del átomo de potasio contiene 20
neutrones y 19 protones.
UNIONES QUÍMICAS
Hemos dichos que las reacciones químicas se producen a nivel de los electrones.
Los átomos pueden ceder o ganar
electrones según sus propias
características, en general:
-
cuando
un átomo interviene en una reacción
química, tiende a adquirir la configuración del gas inerte más cercano. (por
más cercano entendemos el gas inerte cuyo número atómico está más cerca del
elemento en cuestión.) Ejemplo: El
flúor tiene tendencia a ganar un electrón y el calcio a ceder dos electrones.
Ambos tienden a adquirir la configuración electrónica del Neón
Se denomina
ION a un átomo o grupo de átomos que poseen carga eléctrica
Si un átomo gana electrones tiene carga
eléctrica negativa, se lo llama anión. Si un átomo cede electrones, tiene
exceso de carga eléctrica positiva, se lo llama catión
Se denomina UNION QUIMICA a la interacción ( intercambiar o compartir)
que existe entre los átomos que conforman una molécula
Distinguimos los siguientes tipos de uniones:
UNION ELECTROVALENTE u IONICA
Dos átomos tienen unión electrovalente cuando
uno de ellos cede al otro átomo uno o dos electrones. Cada átomo queda con un
exceso de carga eléctrica opuesta al otro, lo que permite que aparezca una
fuerza de atracción entre ambos.
Se presentan uniones electrovalentes
generalmente cuando intervienen elementos del grupo 1 o 2ª y de 6 o 7A
Los compuestos que resultan se denominan iónicos
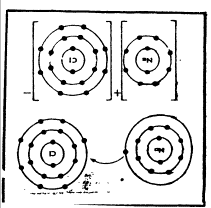
UNION COVALENTE SIMPLE
Dos átomos
tienen unión covalente simple cuando ambos aportan un electrón y el par
compartido por ambos átomos
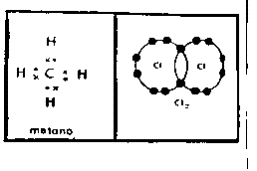
Forman este tipo de unión los
elementos que se encuentran en el centro de la tabla
UNION COVALENTE COORDINADA
Como en el caso anterior dos
átomos comparten dos electrones pero éstos son aportados por un solo átomo
|
TRABAJO PRACTICO N° 12 REACCIONES QUÍMICA - CONSERVACIÓN DE LA MASA OBJETIVO: Obtener oxígeno y
dióxido de carbono. Verificar que la masa se conserva en las reaccione s
químicas ELEMENTOS: -
50 ó 60 ml de agua oxigenada 20 vol. -
tabletas efervescentes -
bicarbonato de sodio -
una pizca de dióxido de manganeso (catalizador) -
vinagre -
tubos de ensayo -
tapones para tubos
de ensayo -
erlenmeyer, matraz o frasco con tapones: uno con un
agujero y otro sin agujero -
codo de vidrio -
cubeta grande -
manguera -
soportes EXPERIMENTACIÓN: A) Obtención de
oxígeno -
Coloque en el matraz el agua oxigenada con una pizca
de dióxido de manganeso (que como catalizador, no interviene en la reacción
pero que la acelera) y tape el matraz -
Para recoger el oxígenos que se desprende en el tapón
del matraz inserte previamente, el tubo acodado. En el otro extremos de éste,
inserte la manguera. El extremo libre de la manguera se coloca debajo de un tubo de ensayo, lleno
de agua , colocado boca abajo en la cubeta llena de agua -
Al desprenderse el oxígeno pasa por la manguera la
tubo de ensayo y el agua de éste desciende. Con el tapón para tubos de ensayo se lo tapa rápidamente sacándolo
de la cubeta -
Para reconocer que el gas es oxígeno acerque a la boca del tubo una astilla con un punto
de ignición. El fuego se avivará B) obtención de
dióxido de carbono (CO2) -
con el mismo equipo del punto A -
se colocan en el matraz agua y las pastillas
efervescentes o bien bicarbonato de socio y vinagre -
para reconocer el dióxido de carbono se lo hace
burbujear en agua de cal, que se enturbia. Para hacerlo burbujear . Se
conecta una manguera al tapón del tubo de ensayo, y el extremo libre se
sumerge en agua de cal. El agua de cal se prepara de la siguiente manera:
Colocar una cucharadita de cal viva en un vaso. Agregar agua. Agitar con una
varilla de vidrio y filtrar enseguida. La preparación debe quedar incolora C) Conservación de
la masa -
Medir la masa de un frasco con agua tapado -
Medir la masa de una pastilla efervescente. -
Destapar el frasco, introducir la pastilla con el frasco inclinado, tapar el
frasco, mezclar la pastilla con el
agua. -
Medir la masa del frasco tapado |
CONSERVACIÓN DE LA MASA
|
EN LAS REACCIONES QUÍMICAS
LA MASA SE MANTIENE CONSTANTE |
La verificación de este principio ha permitido
la elaboración de fórmulas y de ecuaciones químicas, ya hemos escrito a lo
largo del desarrollo algunas fórmulas como la del agua, del oxígeno del dióxido
de carbono.
La siguiente ecuación química muestra como se
produce una reacción química. Las sustancias del primer miembro son los
reaccionantes y los del segundo los productos
La ecuación muestra que dos moléculas de ácido
clorhídrico reaccionan con una molécula de hidróxido de calcio para dar cloruro
de calcio y agua
![]()
Una ecuación química muestra
no sólo cómo se conforman las moléculas que intervienen sino en que proporción
reaccionan
PESO MOLECULAR: de una sustancia es la suma de
los pesos atómicos de los átomos de la molécula
MOL: Un mol de una sustancia es una
cantidad de la misma, medida en gramos
igual al peso molecular
ATOMO GRAMO: Es una cantidad en gramos de un
elementos, igual a su peso atómico
EJEMPLO:
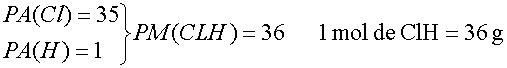
La ecuación del ejemplo nos
indica , calculando todos los pesos moleculares que: 72 gr. de ClH más 74 gr.
de hidróxido de calcio dan 110 gr. de cloruro de calcio y 36 gr. de agua.
Con esta proporción es posible calcular qué
cantidad de productos se obtendrán con distintas cantidades de reaccionantes
mediante una regla de tres simple
EJERCICIOS
1)
Usando la
tabla periódica resuelva el crucigrama
|
1 |
|
|
2 |
|
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
5 |
6 |
|
7 |
|
8 |
|
|
9 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
12 |
|
13 |
|
14 |
|
15 |
16 |
|
|
|
17 |
|
|
|
|
|
|
18 |
|
|
|
20 |
|
|
|
Referencia horizontales
1) Elemento del grupo 4 A y período 2
5 Nombre
del elemento que se utiliza como patrón para determinar los pesos atómicos de
los átomos
9
Nombre del
elemento anterior al silicio, de la familia del boro
10
símbolo
químico del cobalto
11
símbolo
químico del cobre
12
Elemento que
posee 11 protones y 12 neutrones en el núcleo
15
Actínido de
NA = 92
17 Átomo
o grupo de átomos con carga eléctrica
18 Símbolo químico del litio
19 Símbolo químico del germanio
20 Símbolo químico de la plata
referencia
verticales
1 Símbolo del elemento de NA= 46
2 Elemento del grupo $ A, período 4
3 Elemento al que tiende a parecerse el flúor
cuando se combina
4 Verbo loar, primera persona del singular
presente indicativo
5 halógeno de peso atómico 17
6 Símbolo químico del oro
7 Símbolo químico del bismuto
8 Elemento del período 4 ubicado entre el
cobalto y el cobre
9 Elemento del período 7, grupo 3b
13
verbo decir
14
indio que
habitaba en tierra del fuego
15
símbolo
químico del grupo 4ª, período 3
2)
El
científico ruso Mendelejeff fue el primero en ordenar los elementos, pero lo
hizo según los pesos atómicos. Lo brillante de esta primera tabla es que
Mendelejeff dejó libres algunos espacios dónde supuso, acertadamente, que irían
elementos que aún no habían sido descubiertos
Observe atentamente la tabla e indique cuáles
elementos no estarían en el mismo lugar con el ordenamiento por pesos atómico
3)
En la
ecuación química siguiente se combinan tres moléculas de ácido nítrico con una
molécula de hidróxido de aluminio y se obtienen como productos una molécula de
aluminio y tres de agua, en símbolos:
![]()
Usando la tabla periódica:
-
determine
los pesos moleculares de cada sustancia
-
Calcule
cuántos moles de nitrato de aluminio se formarán a partir de 5 moles de ácido
nítrico y cantidad suficiente de hidróxido de aluminio
-
Calcule
cuantos moles de agua se formarán a partir de medio mol de hidróxido de
aluminio y cantidad suficiente de ácido nítrico. Cuántos gramos de agua son.
-
Si
reaccionan 7 gr. de ácido nítrico con 2
moles de hidróxido de aluminio. ¿Se combina todo el ácido?
4)
Indique
cuantos neutrones hay en el núcleo de los átomos nombrados en el crucigrama
5)
EXPERIENCIA:
GALVANOPLASTIA
OBJETIVO: Mostrar el comportamiento de las
sustancias frente a la corriente eléctrica
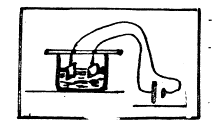
ELEMENTOS: una cubeta ( o vaso
de precipitados), una varilla de vidrio, alambre, una laminilla de cobre, una
laminilla de latón, 6 pilas, algunos
cristales de sulfato de cobre, agua.
-
Armar el
dispositivo de la figura
-
Colocar en
la cubeta los cristales de sulfato disueltos en el agua
-
Se conecta
el polo positivo de la batería a la laminilla de cobre, el negativo a la de
latón.
CONCLUSIÓN
Por efecto de la corriente eléctrica la molécula
de sulfato de cobre se descompone en dos iones :
El ion sulfato
SO4 = y el ion cobre Cu++.
El cobre se deposita en la laminilla de latón.
El ion sulfato " regenera" el sulfato
de cobre tomándolo de la laminilla de cobre